Accesso ai farmaci per le malattie rare: come ridurre le...
Numerose le criticità rilevate dal gruppo di lavoro che ha...
Il 30 e 31 marzo 2023 si è svolto a Roma il primo Forum dedicato alle Politiche Farmaceutiche Regionali, dal titolo “Riflessioni e proposte per condividere gli strumenti di governance dell’assistenza farmaceutica regionale”. Il presente articolo illustra i risultati del Gruppo di Lavoro (GdL), coordinato dagli autori del presente scritto, che ha affrontato il tema dell’accesso regionale ai farmaci per le malattie rare.
Nell’inquadrare le politiche di accesso ai farmaci a designazione orfana a livello nazionale, il GdL ha rilevato che, nonostante l’introduzione di un percorso accelerato per la negoziazione di Prezzo & Rimborso dei farmaci orfani, i tempi di chiusura delle contrattazioni tra AIFA e Industria sono più lunghi per gli orfani.
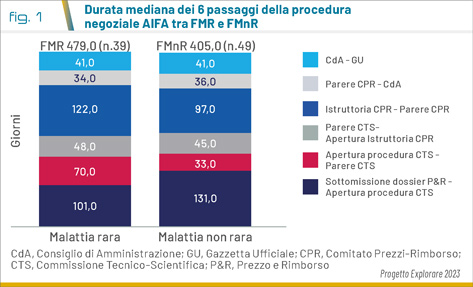 La ricerca del progetto Explorare 2023 (periodo ottobre 2018 - aprile 2022) ha infatti evidenziato che, confrontando le tempistiche dei farmaci per malattie rare (FMR) con quelle dei farmaci per malattie NON rare (FMnR), si osserva che il tempo mediano totale di valutazione dei FMR risulta essere stato del 18% più lungo rispetto al tempo impiegato per i FMnR. Nello specifico il tempo dei FMR è stato di 479 giorni (min 270 e max 877) e di 405 giorni (min 306 e max 756) per i FMnR (Fig. 1).
La ricerca del progetto Explorare 2023 (periodo ottobre 2018 - aprile 2022) ha infatti evidenziato che, confrontando le tempistiche dei farmaci per malattie rare (FMR) con quelle dei farmaci per malattie NON rare (FMnR), si osserva che il tempo mediano totale di valutazione dei FMR risulta essere stato del 18% più lungo rispetto al tempo impiegato per i FMnR. Nello specifico il tempo dei FMR è stato di 479 giorni (min 270 e max 877) e di 405 giorni (min 306 e max 756) per i FMnR (Fig. 1).
Ciononostante i dati del progetto WAIT di IQVIA, supportato dalla European Federation of the Pharmaceutical Industry Association (EFPIA), mostrano come l’Italia sia seconda in Europa dopo la Germania per farmaci orfani rimborsati (82% degli orfani approvati tra il 2018 ed il 2021 sono rimborsati in Italia contro una media europea del 39%, fortemente condizionata dai Paesi dell’Est Europa), con tempi di approvazione al rimborso più ridotti rispetto a Francia e Spagna e diversi altri Paesi Europei.
Con riferimento all’accesso regionale di farmaci orfani rimborsabili (Fascia A/H), i tempi e le modalità di accesso nelle singole regioni ai farmaci per malattie rare non differiscono sensibilmente rispetto a quanto accade per tutti gli altri farmaci ma i tempi di accesso regionale per gli orfani sono spesso più dilatati, anche a causa del frequente costo unitario elevato, che viene percepito dalle direzioni ospedaliere e dai prescrittori in modo più critico.
Il Rapporto dell’Osservatorio sui Farmaci Orfani ha rilevato che, a fronte di una tendenziale riduzione dei tempi tra approvazione AIFA e disponibilità regionale, persiste una forte variabilità interregionale, con tempi più rapidi nelle regioni del nord: le regioni che impiegano tempi più lunghi rispetto alla media nazionale sono il Molise, la Valle d’Aosta, la Provincia autonoma di Trento e la Basilicata, alle quali è associato anche il minor numero di farmaci movimentati; le regioni che impiegano minor tempo, con una mediana al di sotto dei 6 mesi sono Sicilia, Campania, Piemonte, Liguria, Veneto, Friuli Venezia Giulia, Lazio e Lombardia, alle quali si associa il numero dei farmaci orfani movimentati più alto.
Nel periodo di riferimento 2016 -2021 il tasso di disponibilità regionale dei farmaci orfani va dal 16% della Valle d’Aosta (forse i pazienti si riferiscono alle strutture sanitarie di regioni limitrofe, come il Piemonte. NDR) al 91% della Lombardia. La mediana del tempo di commercializzazione in giorni dopo pubblicazione in Gazzetta Ufficiale (cioè il tempo dalla data di trasmissione in Gazzetta Ufficiale, e quindi conclusione del procedimento, alla prima data di movimentazione del farmaco orfano all’interno di ciascuna regione) parte dai 76 giorni della Lombardia per finire ai 455 giorni del Molise, con un valore nazionale di 113 giorni (Tab. 1).

Con riferimento ai farmaci in Fascia C, ovvero i farmaci non rimborsati dal Sistema Sanitario Nazionale (SSN), le eventuali coperture devono avvenire con fondi propri regionali. Le regioni in Piano di Rientro (PdR) non possono autorizzarne il rimborso tout court, ma per i pazienti affetti da malattia rara la copertura è possibile solo previa richiesta nominale alla ASL di residenza del paziente, se il trattamento è ritenuto indispensabile ed insostituibile dal clinico del Centro di riferimento per la diagnosi e cura della malattia rara di cui è affetto. Le differenze interregionali sulla copertura di farmaci in Fascia C e formulazioni galeniche per pazienti affetti da malattie rare sono estremamente rilevanti.
Il GdL ha inoltre segnalato due problematiche specifiche:
- spesso sono presenti farmaci orfani che presentano alcune confezioni o formulazioni rimborsate ed altre in Fascia C, sebbene queste ultime siano più utili al paziente affetto da malattia rara;
- diversi farmaci in Fascia C, pur non essendo classificati come orfani, rappresentano, per i pazienti affetti da malattie rare, le uniche alternative per alleviare i sintomi della patologia di cui sono affetti.
Ulteriori criticità nell'accesso ai farmaci per malattie rare a livello regionale sono:
- le disponibilità economico-finanziarie: in assenza di fondi dedicati, i farmaci per malattie rare rientrano nei tetti sulla spesa farmaceutica (o nel fondo innovativi, se del caso), con le criticità ad essi collegate. Il fatto che spesso il singolo trattamento orfano presenti un costo unitario più elevato rispetto a un trattamento non orfano, sebbene sia riservato ad un numero limitato di pazienti, ne rallenta ulteriormente la messa a disposizione;
- i tempi di definizione dei percorsi del paziente (referral, centri abilitati alla prescrizione), conseguenti alle comunicazioni di AIFA, quali le delibere/note regionali di presa d'atto, l'individuazione dei centri prescrittori e le relative indicazioni operative agli stessi;
- i successivi tempi di acquisto dei farmaci da parte delle aziende sanitarie;
- una gestione non omogenea della mobilità sanitaria interregionale e della relativa compensazione finanziaria;
- una sostanziale difficoltà, segnalata dai farmacisti ospedalieri, nella gestione delle operazioni di importazione per i farmaci esteri per patologia rara, anche se questi costituiscono il gold standard;
- un problema crescente di carenza di farmaci segnalato da medici referenti dei Centri Regionali Malattie Rare e dai farmacisti del SSN (ospedalieri e dei servizi farmaceutici territoriali).
Il GdL, partendo dal quadro di riferimento nazionale e regionale e dagli elementi critici rilevati, ha formulato una serie di raccomandazioni, di seguito riportate.
- Rafforzare l’attività di Horizon Scanning AIFA ai fini della programmazione del percorso di accesso dei farmaci orfani, ottimizzando lo scambio informativo tra AIFA e regioni con specifici flussi informativi bidirezionali riguardanti sia la negoziazione delle condizioni di accesso, sia il monitoraggio post-marketing.
- Dare attuazione alle indicazioni già previste (quali i decreti attuativi della L. 189/2022).
- Monitorare l’effettivo accesso dei pazienti ai farmaci orfani tramite l’individuazione di specifici indicatori.
- Semplificare le procedure di acquisto, rendendole più rapide ed efficaci nel rispetto della normativa vigente, valutando l'opportunità di realizzare una procedura d’acquisto unica a livello nazionale per i farmaci orfani per il tramite di una centrale di committenza regionale che si faccia carico della procedura unica.
- Condividere e uniformare tra regioni il percorso di gestione nell'assistenza farmaceutica del paziente in mobilità interregionale (tramite il coinvolgimento della Conferenza Stato-Regioni, CSR).
- Realizzare un monitoraggio attento e puntuale da parte di AIFA su carenze ed indisponibilità dei farmaci orfani prevedendo, qualora siano legate a considerazioni di tipo economico da parte delle imprese, anche la possibilità di riconoscere un adeguamento dei prezzi. Nel caso di principi attivi a brevetto scaduto, una soluzione potrebbe essere di centralizzarne la produzione a carico di AIFA presso lo Stabilimento Chimico Farmaceutico Militare o stipulare convenzioni con aziende di produzione galenica.
- Rendere omogenea su tutto il territorio nazionale la fornitura a carico del SSN dei farmaci in Fascia C e dei prodotti galenici per la patologia in oggetto. A tal fine, viene segnalato che tra i documenti già elaborati ed in attesa del vaglio della CSR (Decreti attuativi della L. 175/2021) è presente un elenco che costituirebbe un primo passo in questa direzione.
- Semplificare la procedura di importazione dei farmaci, almeno per i farmaci utilizzati in modo sistematico e per pazienti numerosi (essendo parte dello standard of care): la proposta è di un’autorizzazione unica da parte di AIFA di validità almeno annuale, quando sollecitata da richieste documentate di società scientifiche e/o associazioni di pazienti, come già avviene per alcuni farmaci importati direttamente dal produttore.
In conclusione il GdL, pur riconoscendo gli enormi passi avanti compiuti dal nostro Paese negli ultimi anni nell’assicurare ed accelerare la disponibilità di farmaci orfani, ha confermato l’esistenza di notevoli difformità regionali. L’applicazione delle raccomandazioni elaborate potrebbe ridurre tali disomogeneità a vantaggio dei pazienti rari. Certamente la “messa a terra” di quanto previsto dai recenti Testo Unico e Piano Nazionale Malattie Rare costituiscono elementi imprescindibili nel processo di miglioramento.
Partecipanti al Gruppo di Lavoro: S. Baldovino, R. Banfi, F. Callegaris, F. Caprari, G. Corsico, E. Crovato, E. D'Agostino, A. Malice, A. Marcheselli, R. Pala, M. Pani, F. Perrone, M.R. Puzo, B. Rebesco, A. Scopinaro, A. Sinibaldi, M.E. Soffientini, E. Troiano, F. Venturini
Bibliografia
- Explorare - Rare disease deep dive & proposals. Febbraio 2023. https://www.explorare-rare.it/wp-content/uploads/2023/02/ExploRare-Report-di-progetto-23.2.23.pdf
- EFPIA Patients W.A.I.T. Indicator 2022 Survey. April 2023. https://efpia.eu/media/s4qf1eqo/efpia_patient_wait_indicator_final_report.pdf
- VI° Rapporto annuale OSSFOR. Investimenti e trasparenza dei processi: le condizioni per garantire l’equità di accesso ai malati rari. http://www.osservatoriofarmaciorfani.it/wp-content/uploads/2023/01/VI_Rapporto_OSSFOR_Web.pdf





