Amiloidosi ereditaria da transtiretina: diagnosi precoce e...
L'amiloidosi ereditaria da transtiretina (ATTRv) è una malattia...
L'amiloidosi ereditaria da transtiretina (ATTRv) è una malattia genetica rara a trasmissione autosomica dominante e a esordio in età adulta, causata da mutazioni del gene TTR. Le varianti amiloidogeniche non compromettono la funzione biologica della transtiretina ma riducono la stabilità della conformazione nativa. La perdita di struttura o misfolding della proteina circolante innesca una sequenza di eventi molecolari che ne determinano la progressiva deposizione, a livello extracellulare, in forma di fibre di amiloide (1).
I depositi di amiloide da transtiretina sono sistemici e causano un danno d'organo ingravescente e inesorabilmente fatale se la malattia non viene riconosciuta e trattata tempestivamente. Poiché ogni tessuto può essere potenzialmente colpito, questa patologia è caratterizzata da una notevole variabilità di espressione clinica (2). L'eterogeneità di fenotipo può ostacolarne il riconoscimento e contribuisce al frequente ritardo diagnostico ancora osservato in questi pazienti (3).
Basi molecolari
La transtiretina (o prealbumina) è una proteina di trasporto sintetizzata dal fegato, dai plessi corioidei e dall'epitelio pigmentato retinico. Le sue funzioni biologiche meglio caratterizzate sono il trasporto della tiroxina e il co-trasporto della vitamina A nel plasma attraverso il legame con la retinol binding protein (RBP). Le mutazioni riducono la stabilità della struttura tetramerica nativa della transtiretina e la rendono suscettibile di rimodellamento proteolitico, favorendone la dissociazione in monomeri interi e frammentati (4). Le subunità monomeriche hanno una notevole propensione ad aggregare in forma di fibrille di amiloide.
Sono note oltre 130 varianti amiloidogeniche di transtiretina. La mutazione Val30Met è la più frequente ed è particolarmente prevalente nella popolazione portoghese, svedese e giapponese. In Italia questa variante, pur essendo la più rappresentata, è responsabile della malattia solo nel 25% dei pazienti (5). Nella nostra popolazione vi è, infatti, una notevole eterogeneità di genotipo, con oltre 30 diverse mutazioni identificate.
Esiste una significativa relazione tra genotipo e fenotipo clinico: alcune varianti si associano a un prevalente interessamento del sistema nervoso periferico e autonomo (fenotipo neurologico) e altre si caratterizzano per un pressoché esclusivo danno cardiaco (fenotipo cardiaco). Tra i due estremi si colloca peraltro la maggior parte delle mutazioni note, in cui il coinvolgimento neurologico e quello cardiaco sono associati (fenotipo misto). Anche l’età di esordio varia in base al tipo di mutazione. Il fenotipo misto con esordio oltre i 50 anni di età (late-onset) è largamente prevalente nella popolazione italiana.
Presentazione clinica
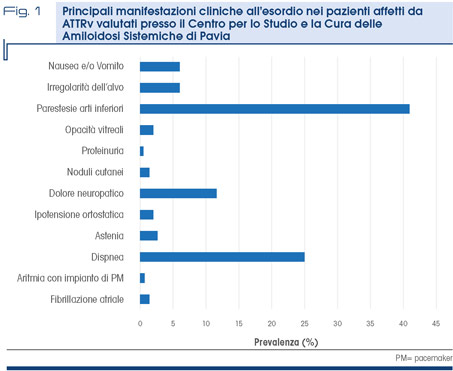 I sintomi di esordio sono molto eterogenei, dipendendo dal tipo di mutazione (Fig. 1).
I sintomi di esordio sono molto eterogenei, dipendendo dal tipo di mutazione (Fig. 1).
Tuttavia, la storia clinica spesso evidenzia una sindrome del tunnel carpale, monolaterale o bilaterale, che anticipa anche di anni la comparsa delle altre manifestazioni (6). L’interessamento del sistema nervoso periferico determina una polineuropatia assonale sensitivo-motoria, simmetrica, con distribuzione lunghezza-dipendente, che solitamente esordisce agli arti inferiori. Spesso sono inizialmente colpite soprattutto le fibre nervose di piccolo calibro, causando parestesie, dolore neuropatico e alterazione della sensibilità termica. Gradualmente il danno progredisce anche a carico delle fibre nervose di maggiore calibro, sia sensitive sia motorie, e si estende anche agli arti superiori (2). Sulla base della compromissione motoria, che determina ipostenia e ipotrofia muscolare ingravescente, la neuropatia da TTR viene classificata in tre stadi (Coutinho FAP score). Nello stadio I la deambulazione è autonoma, nello stadio II la deambulazione è possibile con uno o due appoggi, nello stadio III il paziente non è più in grado di muoversi, neanche con il deambulatore e necessita pertanto della sedia a rotelle.
Il coinvolgimento del sistema nervoso autonomo causa disfunzione erettile, spesso precoce, ritenzione urinaria, ipotensione ortostatica e turbe della motilità gastrointestinale come stipsi ostinata, stipsi alternata a diarrea o diarrea cronica, con perdita di peso e malnutrizione.
L’interessamento cardiaco può rappresentare l'unica manifestazione clinica (in Italia il fenotipo cardiaco è molto frequente nelle regioni centro-settentrionali in associazione alla variante Ile68Leu) oppure può essere presente insieme al quadro neurologico.
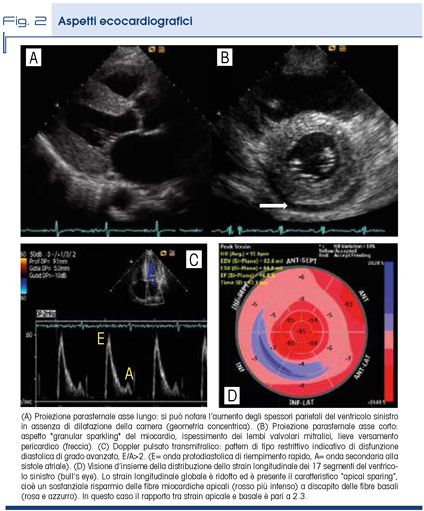 In entrambi i casi, la presenza di danno cardiaco incide sulla prognosi e riduce l'aspettativa di vita dei pazienti con ATTRv, se non trattata. L’infiltrazione miocardica causa ispessimento e rigidità delle pareti ventricolari in assenza di dilatazione della camera. La compliance ventricolare è ridotta con conseguente aumento delle pressioni di riempimento telediastoliche, che si ripercuotono sugli atri causandone la dilatazione. Il pattern che viene a configurarsi è quello di una cardiopatia restrittiva con pseudoipertrofia concentrica. La malattia può esordire con dispnea da sforzo, edemi declivi, astenia ingravescente, progressiva intolleranza a una terapia antipertensiva già in corso oppure con eventi aritmici, come bradiaritmia o fibrillazione atriale. L’elettrocardiogramma può mostrare bassi voltaggi, anomalie di conduzione, pseudonecrosi, alterazioni del tratto ST da sovraccarico e frammentazione del complesso QRS. Le caratteristiche ecocardiografiche sono riassunte in figura 2.
In entrambi i casi, la presenza di danno cardiaco incide sulla prognosi e riduce l'aspettativa di vita dei pazienti con ATTRv, se non trattata. L’infiltrazione miocardica causa ispessimento e rigidità delle pareti ventricolari in assenza di dilatazione della camera. La compliance ventricolare è ridotta con conseguente aumento delle pressioni di riempimento telediastoliche, che si ripercuotono sugli atri causandone la dilatazione. Il pattern che viene a configurarsi è quello di una cardiopatia restrittiva con pseudoipertrofia concentrica. La malattia può esordire con dispnea da sforzo, edemi declivi, astenia ingravescente, progressiva intolleranza a una terapia antipertensiva già in corso oppure con eventi aritmici, come bradiaritmia o fibrillazione atriale. L’elettrocardiogramma può mostrare bassi voltaggi, anomalie di conduzione, pseudonecrosi, alterazioni del tratto ST da sovraccarico e frammentazione del complesso QRS. Le caratteristiche ecocardiografiche sono riassunte in figura 2.
L’unica metodica di imaging che consente di identificare con elevata sensibilità e specificità i depositi di amiloide da TTR nel cuore è la scintigrafia con tracciante osseo (99mTc-DPD, 99mTc-HMDP e 99mTc-PYP) (7). Sebbene molto rare, altre manifestazioni cliniche possono costituire il quadro di esordio, come proteinuria o opacità vitreali (Fig. 1).
Diagnosi
La diagnosi si basa sul riscontro di una mutazione di significato patologico del gene TTR e sulla identificazione di depositi di amiloide formati da transtiretina ad un esame istologico. La presenza di depositi di amiloide può essere in prima istanza ricercata mediante una biopsia non invasiva, come l’aspirato di grasso periombelicale o la biopsia delle ghiandole salivari minori labiali. La sensibilità di queste metodiche non è tuttavia elevata nell'ATTRv.
Pertanto, in alcuni casi, può essere necessario ricorrere alla biopsia d'organo, ad esempio la biopsia endomiocardica.
Una biopsia positiva consente di tipizzare le fibrille di amiloide mediante indagine immunoistochimica, preferibilmente ultrastrutturale (8), o mediante analisi proteomica (9), al fine di confermare definitivamente la presenza di depositi di transtiretina.
Tuttavia, una franca captazione miocardica (score 2 o 3 di Perugini (7)) alla scintigrafia con tracciante osseo, ad esempio DPD, è oggi accettata come evidenza indiretta del deposito di transtiretina a livello cardiaco e può pertanto sostituire una biopsia positiva (10). Nell'eventualità in cui il paziente, oltre alla mutazione di transtiretina, presenti anche una componente monoclonale nel siero e/o nelle urine, è necessario escludere con certezza una amiloidosi AL. In questi casi l'esecuzione di una biopsia, anche invasiva come quella miocardica, ha un'indicazione assoluta e rappresenta una priorità per giungere a una diagnosi accurata in tempi brevi, garantendo l'accesso alla terapia corretta.
Terapia
L’approccio al paziente con ATTRv deve essere multidisciplinare, avvalendosi dell’intervento di più specialisti in base alla presentazione clinica e al danno d'organo prevalente. Oltre al trattamento specifico finalizzato ad arrestare la deposizione di amiloide, la terapia di supporto è fondamentale per la gestione dello scompenso cardiaco, delle aritmie, del dolore neuropatico, dell'ipotensione e delle manifestazioni gastrointestinali, che impattano drammaticamente sulla qualità di vita.
Le strategie terapeutiche consolidate includono la soppressione della concentrazione di transtiretina circolante con farmaci gene-silencing come inotersen e patisiran e la stabilizzazione del tetramero con tafamidis, che ostacola la dissociazione e il misfolding della transtiretina. Inoltre, dal 1990 fino a tempi recenti, alcuni pazienti hanno beneficiato del trapianto di fegato che, rimuovendo la proteina mutata dal circolo e sostituendola con quella normale, si è dimostrato efficace nell’arrestare la neuropatia periferica prolungando significativamente la sopravvivenza.
L'esperienza accumulata in quasi 30 anni ha tuttavia mostrato che i pazienti con fenotipo late-onset e con mutazioni non-Val30Met ottengono un beneficio molto limitato da questa procedura, a causa della progressione del danno cardiaco anche dopo il trapianto (11). Poiché nella nostra popolazione questi pazienti sono la maggioranza, in Italia il trapianto di fegato è stato relativamente poco utilizzato e attualmente è limitato a casi isolati.
Inotersen
Inotersen è un oligonucleotide antisenso che lega e degrada negli epatociti l'mRNA della transtiretina mutata e normale. Inotersen sopprime pertanto la sintesi della proteina, la cui concentrazione circolante si riduce quasi dell'80%. L'efficacia e la sicurezza di inotersen nel trattamento della ATTRv in pazienti con polineuropatia in stadio FAP I e II è stata dimostrata nello studio di fase III NEURO-TTR (12), in cui i pazienti randomizzati al trattamento hanno mostrato una significativa riduzione della progressione della neuropatia e un miglioramento della qualità di vita rispetto ai pazienti nel gruppo di controllo con placebo.
I dati dello studio di estensione recentemente pubblicato confermano la persistenza del beneficio clinico (13).
La somministrazione è per via sottocutanea una volta alla settimana. Inotersen è stato approvato dalla European Medicines Agency (EMA) per il trattamento della amiloidosi ATTRv con neuropatia periferica in stadio FAP I e II ed è ora prescrivibile anche in Italia.
Patisiran
Analogamente a inotersen, patisiran sopprime la sintesi epatica della transtiretina ma agisce con un meccanismo di silenziamento genico che sfrutta il processo di RNA interference.
Patirisan degrada l'mRNA della transtiretina mutata e normale, riducendo la concentrazione circolante di oltre l'80%. Il farmaco si somministra ogni tre settimane per via endovenosa, preceduto da una premedicazione.
L'efficacia e la sicurezza di patisiran nel trattamento della ATTRv con neuropatia in stadio I e II sono state valutate in uno studio clinico di fase III (APOLLO) che ha mostrato la significativa superiorità del trattamento rispetto al placebo nell'indurre il miglioramento della polineuropatia periferica e autonomica, preservando la qualità di vita e la capacità funzionale (14). Il farmaco è oggi prescrivibile in Italia con questa indicazione.
Tafamidis
Tafamidis è il primo farmaco disegnato per stabilizzare la conformazione tetramerica della TTR prevenendone la dissociazione in monomeri amiloidogenici.
L'efficacia e sicurezza di tafamidis 20 mg/die nel rallentare la progressione della neuropatia nei pazienti in stadio FAP I sono state dimostrate in uno studio di fase III controllato verso placebo, seguito da due studi in aperto.
La terapia è attualmente approvata in Italia a questo dosaggio e con questa indicazione. Più recentemente lo studio ATTR-ACT ha dimostrato l’efficacia di tafamidis nella cardiomiopatia da transtiretina. Dopo 30 mesi di terapia tafamidis ha ridotto significativamente il rischio di morte e di ospedalizzazioni per cause cardiovascolari rispetto al gruppo placebo (15). Sulla base di questi dati il trattamento con tafamidis al dosaggio di 80 mg/die è stato approvato da EMA ed è in attesa di rimborsabilità in Italia per la cardiomiopatia da transtiretina.
Consulenza genetica e test presintomatico
L'identificazione di un familiare affetto da ATTRv pone agli altri membri della famiglia importanti interrogativi relativi al rischio di ricorrenza della patologia e all'opportunità di sottoporsi al test genetico presintomatico. La crescente disponibilità di terapie efficaci, in grado di indurre un beneficio tanto maggiore quanto più precocemente iniziate, rende il test presintomatico uno strumento importante per impostare un adeguato monitoraggio.
D'altra parte le implicazioni emotive, psicologiche, relazionali e sociali di questo esame non devono mai essere sottovalutate. Come per altre patologie neurodegenerative a esordio tardivo, vi è unanime consenso sulla necessità di effettuare sempre il test presintomatico nel contesto di un percorso di consulenza genetica possibilmente multidisciplinare, che garantisca una comunicazione adeguata nella fase pre-test e una presa in carico a lungo termine in caso di esito positivo (16).
Conclusioni
Stiamo vivendo un periodo di grande avanzamento nella gestione clinica e terapeutica dei pazienti con amiloidosi ereditaria da transtiretina, grazie alla crescente disponibilità di strumenti diagnostici accurati e allo sviluppo di terapie efficaci.
La diagnosi precoce è pertanto indispensabile per preservare la qualità di vita, prevenire la disabilità e ottimizzare la prognosi.
Bibliografia
- Merlini G, Bellotti V. Molecular mechanisms of amyloidosis. N Engl J Med. 2003;349:583-96.
- Adams D, Koike H, Slama M, et al. Hereditary transthyretin amyloidosis: a model of medical progress for a fatal disease. Nat Rev Neurol. 2019;15:387-404.
- Cortese A, Vegezzi E, Lozza A, et al. Diagnostic challenges in hereditary transthyretin amyloidosis with polyneuropathy: avoiding misdiagnosis of a treatable hereditary neuropathy J Neurol Neurosurg Psychiatry. 2017;88:457-458.
- Marcoux J, Mangione PP, Porcari R, et al. A novel mechano-enzymatic cleavage mechanism underlies transthyretin amyloidogenesis. EMBO Mol Med. 2015;7:1337-1349.
- Parman Y, Adams D, Obici L, et al. Sixty years of transthyretin familial amyloid polyneuropathy (TTR-FAP) in Europe: where are we now? A European network approach to defining the epidemiology and management patterns for TTR-FAP. Curr Opin Neurol. 2016;29 Suppl 1:S3-S13.
- Milandri A, Farioli A, Gagliardi C, et al. Carpal tunnel syndrome in cardiac amyloidosis: implications for early diagnosis and prognostic role across the spectrum of aetiologies. Eur J Heart Fail. 2020;22:507-515.
- Perugini E, Guidalotti PL, Salvi F, et al. Noninvasive etiologic diagnosis of cardiac amyloidosis using 99mTc-3,3-diphosphono-1,2-propanodicarboxylic acid scintigraphy. J Am Coll Cardiol. 2005; 46:1076-84.
- Fernandez de Larrea C, Verga L, Morbini P, et al. A practical approach to the diagnosis of systemic amyloidoses. Blood. 2015;125:2239-2244.
- Brambilla F, Lavatelli F, Di Silvestre D, et al. Reliable typing of systemic amyloidoses through proteomic analysis of subcutaneous adipose tissue. Blood. 2012;119:1844-1847.
- Gillmore JD, Maurer MS, Falk RH, et al. Nonbiopsy diagnosis of cardiac transthyretin amyloidosis. Circulation. 2016;133:2404-12.
- Ericzon BG, Wilczek HE, Larsson M, et al. Liver Transplantation for Hereditary Transthyretin Amyloidosis: After 20 Years Still the Best Therapeutic Alternative? Transplantation. 2015;99:1847-1854.
- Benson MD, Waddington-Cruz M, Berk JL, et al. Inotersen treatment for patients with hereditary transthyretin amyloidosis. N Engl J Med. 2018;379:22-31.
- Brannagan TH, Wang Ak, Coelho T, et al. Early Data on Long-Term Efficacy and Safety of Inotersen in Patients With Hereditary Transthyretin Amyloidosis: A 2-Year Update From the Open-Label Extension of the NEURO-TTR Trial. Eur J Neurol. 2020; e-Pub ahead of print
- Adams D, Gonzalez-Duarte A, O’Riordan WD, et al. Patisiran, an RNAi Therapeutic, for Hereditary Transthyretin Amyloidosis. N Engl J Med. 2018;379:11-21.
- Maurer MS, Schwartz JH, Gundapaneni B, et al. Tafamidis treatment for patients with transthyretin amyloid cardiomyopathy. N Engl J Med. 2018;379:1007-1016.
- Obici L, Kuks JB, Buades J, et al. Recommendations for presymptomatic genetic testing and management of individuals at risk for hereditary transthyretin amyloidosis. Curr Opin Neurol. 2016;29 Suppl 1:S27-35.