Cause rare di ipertensione: iperaldosteronismo primitivo |...
Nonostante rientri ancora nel registro delle malattie rare...
L’iperaldosteronismo primitivo (IP) è una condizione caratterizzata da un’eccessiva produzione di aldosterone da parte di uno o entrambi i surreni, che si associa alla comparsa di ipertensione, disordini elettrolitici ed eventi cardio- e cerebro-vascolari. La diagnosi precoce e una terapia adeguata sono fondamentali per prevenire la comparsa delle complicanze a lungo termine a cui questa condizione è associata.
Epidemiologia
Nonostante l’IP da iperplasia surrenalica rientra ancora nel registro delle malattie rare (RCG010), dati relativamente recenti suggeriscono che in realtà sia presente nel 5-10% dei pazienti con ipertensione arteriosa, rappresentando la causa più comune di ipertensione secondaria.
La prevalenza dell’IP aumenta all’aumentare della gravità dell’ipertensione, presentandosi nel 2-7% dei pazienti con ipertensione lieve-moderata e in oltre il 20% dei pazienti con ipertensione grave o resistente. Nonostante la sua elevata prevalenza, l’IP rimane ancora una condizione ampiamente sotto diagnosticata a causa della scarsa consapevolezza della malattia e della complessità dei test di screening proposti dalle linee guida.
Patogenesi
L'aldosterone è un ormone prodotto nella zona glomerulosa del surrene, la cui sintesi è principalmente regolata dal sistema renina-angiotensina e dalle concentrazioni di potassio extracellulari. Fisiologicamente, l’aldosterone interviene negli stati di deplezione di sodio e di volume poiché determina un aumento del riassorbimento del sodio nel tubulo renale, che a sua volta stimola il riassorbimento di acqua, in scambio di ioni potassio o idrogeno.
Nell’IP, invece, la produzione di aldosterone è inappropriatamente elevata rispetto al contenuto di sodio e al volume sanguigno e relativamente indipendente dai suoi principali regolatori. Questo porta a: incremento pressorio, ritenzione di sodio, soppressione della secrezione di renina, aumento dell’escrezione di potassio e alcalosi metabolica. L'iperplasia surrenale bilaterale (Bilateral Adrenal Hyperplasia, BAH) e l’adenoma producente aldosterone (Aldosterone-Producing Adenoma, APA) sono i due sottotipi più comuni di IP, rappresentando rispettivamente il 60-70% e il 30-40% dei casi. In genere, l’APA si manifesta intorno ai 30-50 anni e si associa a un fenotipo di malattia più florido, mentre la BAH insorge ad un’età più avanzata ed è clinicamente meno grave. Cause più rare sono il carcinoma secernente aldosterone e le forme di IP familiare.
Diagnosi
La diagnosi dell’IP è biochimica e si basa sulla dimostrazione di valori di renina bassi o soppressi associati a livelli di aldosterone inappropriatamente normali o francamente elevati. Se si conferma un eccesso di aldosterone, è indicato procedere con la valutazione del sottotipo, fondamentale per la scelta terapeutica. Pertanto, l’iter diagnostico può essere classificato in 3 fasi (Fig. 1).
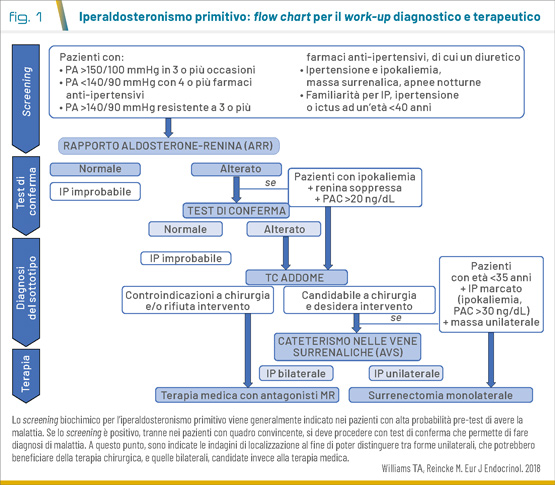
Screening
Le attuali linee guida raccomandano di eseguire lo screening in pazienti affetti da: ipertensione grave e/o resistente, ipertensione associata a ipokaliemia, incidentaloma surrenale, sindrome delle apnee notturne, storia familiare di ipertensione ad esordio precoce o eventi cerebrovascolari insorti prima dei 40 anni e a tutti i soggetti ipertesi con parenti di primo grado affetti da IP.
Il test di screening considerato di prima scelta è il rapporto tra la concentrazione plasmatica di aldosterone (PAC) e la renina, espressa come attività reninica plasmatica (PRA) o concentrazione di renina attiva diretta (DRC), definito ARR (aldosterone-to-renin ratio). Numerosi farmaci e condizioni sono in grado di influenzare il dosaggio di aldosterone e renina, e quindi l’ARR, con conseguenti falsi positivi e falsi negativi (Tab. 1). Pertanto, prima della valutazione si raccomanda la correzione dell’ipokaliemia, se presente, una dieta libera nell’assunzione di sale e, quando possibile, la sospensione dei farmaci anti-ipertensivi interferenti da 2 a 4 settimane prima del test, con possibilità di ricorrere a farmaci sostitutivi che hanno un minimo effetto sull’ARR (calcio-antagonisti non diidro-piridinici, alfa-bloccanti).
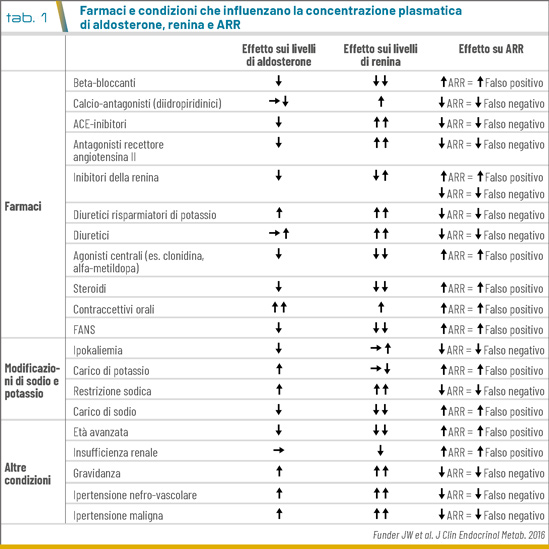
A causa della mancata uniformità nei protocolli diagnostici e nei metodi di analisi per misurare aldosterone e renina, vi è una sostanziale variabilità nelle soglie diagnostiche. Il cutoff più ampiamente accettato per definire la positività dello screening è un ARR >30 (con aldosterone espresso in ng/dL e renina in ng/mL/h), che secondo alcuni autori deve essere associato a un livello sierico di aldosterone >15 ng/dL.
Test di conferma
Dato l’alto tasso di falsi positivi, nei pazienti con ARR positivo si raccomanda di procedere con uno o più test di conferma per convalidare o escludere definitivamente la diagnosi di IP. Questo consente di evitare procedure costose ed invasive necessarie per procedere nell’iter diagnostico del sottotipo di IP. I principali test dinamici proposti dalle linee guida sono: il test da carico orale di sodio, il test di infusione salina, il test al captopril e il test al fludrocortisone. I test differiscono in termini di sensibilità e specificità ma non ci sono ancora prove sufficienti che dimostrino la superiorità di uno rispetto agli altri. Pertanto, la scelta del test di conferma è determinata dal costo, dalla compliance del paziente, dalla routine di laboratorio e dall’esperienza del centro.
Solo nei pazienti con quadro convincente di IP, definito dalla presenza di ipokaliemia e risultati dello screening chiaramente patologici (renina soppressa e PAC >20 ng/dL), si può procedere direttamente alla valutazione del sottotipo.
Diagnosi del sottotipo
In tutti i pazienti in cui si conferma l’IP è indicato eseguire un test di imaging, preferibilmente TC, per rilevare eventuali lesioni surrenaliche ed escludere le rare forme dovute a carcinoma surrenalico.
Tuttavia, la TC non è un esame sufficientemente accurato per diagnosticare il sottotipo (sensibilità 87%, specificità 71%), in quanto non è in grado di identificare i piccoli adenomi e/o l’iperplasia surrenalica né differenziare le lesioni che producono aldosterone dalle masse surrenali non funzionanti, un riscontro relativamente comune che in genere non richiede trattamento. Pertanto, dopo l’imaging è indicato procedere con il cateterismo delle vene surrenaliche (adrenal vein samples, AVS), considerato il gold standard nel distinguere le forme di IP unilaterali da quelle bilaterali (sensibilità 95%, specificità 100%). Tuttavia, essendo un esame tecnicamente impegnativo, costoso, invasivo e con potenziali gravi effetti collaterali, dovrebbe essere eseguito in centri di 3° livello e solo in pazienti con biochimica inequivocabile di IP per cui si prospetta una soluzione chirurgica.
L’AVS può essere evitato nel paziente di età <35 anni, con IP marcato (ipokaliemia e PAC >30 ng/dL) ed evidenza di un adenoma surrenalico unilaterale alla TC, data l’alta probabilità di un APA.
Ulteriori valutazioni
Nei pazienti con insorgenza di IP prima dei 20 anni e in coloro che hanno una familiarità per IP o ictus in età <40 anni, si suggerisce di escludere le forme familiari tramite il test genetico. Inoltre, siccome la co-secrezione di cortisolo è un evento relativamente comune nell’IP (4-27% dei casi), in tutti i pazienti con massa surrenalica è indicato eseguire anche il test di soppressione notturna del cortisolo con somministrazione di 1 mg di desametasone come screening dell’ipercortisolismo.
Manifestazioni cliniche
Tendenzialmente l’IP si presenta con ipertensione moderata/grave, talvolta resistente ai trattamenti convenzionali, associata a normali livelli di potassio. Infatti, l’ipokaliemia, in passato considerata un elemento patognomonico, oggi è riconosciuta essere presente solo in una minoranza dei casi (9-37%). L’IP andrebbe sospettato anche in presenza di danni d’organo cardiaci e renali sproporzionati rispetto all’entità dell’ipertensione, in quanto le complicanze ad esso associate sono indipendenti dalla pressione arteriosa. A dimostrazione di ciò i pazienti con IP presentano un rischio aumentato di eventi cardio- e cerebro-vascolari e di mortalità rispetto ai soggetti con ipertensione essenziale, a parità di livelli pressori, sesso ed età.
L’eccesso di aldosterone si associa anche a un’aumentata prevalenza di malattia renale cronica, diabete mellito di tipo 2 e sindrome metabolica, oltre ad un maggior rischio di osteoporosi. Un altro elemento caratteristico è l’apnea ostruttiva del sonno, presente nel 20-35% dei pazienti con IP.
Trattamento
La scelta del trattamento dipende dalla causa sottostante dell’IP.
Nelle forme unilaterali, in paziente candidabile a chirurgia, si raccomanda la surrenectomia monolaterale, in quanto consente la normalizzazione biochimica nella maggioranza dei casi con notevoli benefici clinici post-operatori. Infatti, nella quasi totalità dei pazienti si verifica un miglioramento dell’ipertensione, che consente la riduzione di dosaggi e/o numero dei farmaci anti-ipertensivi fino alla completa guarigione nel 40-50% dei casi, e la risoluzione dell’ipokaliemia, se presente.
Inoltre, è descritta anche una regressione dei danni d’organo correlati e la riduzione della mortalità cardiovascolare.
Nelle forme bilaterali, nei pazienti con IP unilaterale che rifiutano o non sono candidabili a chirurgia e se l’identificazione di IP unilaterale non è riuscita (es. fallimento dell’AVS) è indicata, invece, la terapia medica che includa un antagonista del recettore dei mineralcorticoidi (MR).
Nell’ambito di questa classe, si raccomanda lo spironolattone come prima scelta, o in alternativa il canrenone, il canrenoato di potassio e l’eplerenone. Tali farmaci sono in grado, di solito, di controllare la pressione sanguigna, risolvere l’ipokaliemia e proteggere gli organi bersaglio, ma devono essere assunti per tutta la vita, con maggiori costi a lungo termine, e con possibili effetti collaterali (es. ginecomastia, disfunzione erettile, oligoamenorrea).
Conclusioni
L’IP è una malattia ancora annoverata tra le malattie rare ma in realtà rappresenta una causa relativamente comune di ipertensione. Essendo potenzialmente curabile con significativi benefici a lungo termine sia sulle comorbidità associate che sulla qualità di vita, l’identificazione precoce di tale condizione è una sfida per tutti i medici che si occupano di ipertensione arteriosa. Tuttavia, è necessario un maggiore sforzo per migliorare la consapevolezza della salute pubblica sull’elevata prevalenza dell’IP e del suo rischio cardiovascolare modificabile.
Bibliografia
- Funder JW, Carey RM, Mantero F, et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2016;101(5):1889-916.
- Hundemer GL, Kline GA, Leung AA. How common is primary aldosteronism? Curr Opin Nephrol Hypertens. 2021;30(3):353-360.
- Rossi GP. Primary aldosteronism: JACC state-of-the-art review. J Am Coll Cardiol. 2019;74(22):2799-2811.
- Vaidya A, Hundemer, GL, Nanba K, et al. Primary aldosteronism: state-of-the-art review. Am J Hypertens. 2022; 35.12:967-988.
- Hundemer, GL, Vaidya, A. Primary aldosteronism diagnosis and management: a clinical approach. Endocrinol Metab Clin North Am. 2019;48(4):681-700.
- Reincke M, Bancos I, Mulatero P, et al. Diagnosis and treatment of primary aldosteronism. Lancet Diabetes Endocrinol. 2021;9(12):876-892.
- Turcu AF, Yang J, Vaidya A. Primary aldosteronism—a multidimensional syndrome. Nat Rev Endocrinol. 2022;18(11):665-682.
- Williams TA, Reincke M. Diagnosis and management of primary aldosteronism: the Endocrine Society guideline 2016 revisited. Eur J Endocrinol. 2018;179(1):R19-R29.
- Zennaro MC, Boulkroun S, Fernandes-Rosa FL. Pathogenesis and treatment of primary aldosteronism. Nat Rev Endocrinol. 2020;16(10):578-589.





