Empagliflozin nella glicogenosi tipo Ib: un successo della...
La glicogenosi tipo Ib è un disordine ereditario del metabolismo...
Introduzione
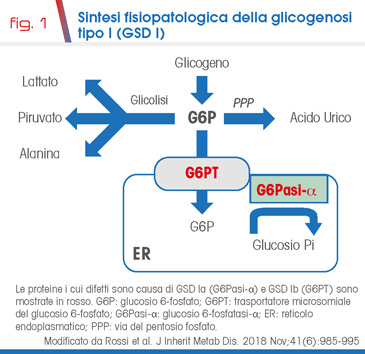 La glicogenosi tipo Ib (GSD Ib, MIM#232220) è un disordine ereditario del metabolismo dei carboidrati a trasmissione autosomica recessiva (prevalenza circa 1/500.000) causato da mutazioni del gene SLC37A4 che codifica per il trasportatore microsomiale del glucosio 6-fosfato (G6PT), espresso ubiquitariamente (Fig. 1). I pazienti affetti da GSD Ib mostrano severa ipoglicemia dopo breve digiuno (circa 2-4 ore), epatomegalia, iperlattatemia, iperlipidemia, iperuricemia, scarso accrescimento, neutropenia/disfunzione neutrofila ed aumentato rischio di malattia infiammatoria cronica intestinale (MICI) e malattie autoimmuni [1]. Nonostante i progressi nella terapia dietetica e farmacologica, le manifestazioni immunologiche impattano ancora oggi fortemente su prognosi e qualità di vita dei pazienti [1].
La glicogenosi tipo Ib (GSD Ib, MIM#232220) è un disordine ereditario del metabolismo dei carboidrati a trasmissione autosomica recessiva (prevalenza circa 1/500.000) causato da mutazioni del gene SLC37A4 che codifica per il trasportatore microsomiale del glucosio 6-fosfato (G6PT), espresso ubiquitariamente (Fig. 1). I pazienti affetti da GSD Ib mostrano severa ipoglicemia dopo breve digiuno (circa 2-4 ore), epatomegalia, iperlattatemia, iperlipidemia, iperuricemia, scarso accrescimento, neutropenia/disfunzione neutrofila ed aumentato rischio di malattia infiammatoria cronica intestinale (MICI) e malattie autoimmuni [1]. Nonostante i progressi nella terapia dietetica e farmacologica, le manifestazioni immunologiche impattano ancora oggi fortemente su prognosi e qualità di vita dei pazienti [1].
La neutropenia/disfunzione neutrofila (presente in più dell’80% dei pazienti con GSD Ib) è causa di frequenti infezioni (anche gravi) ed aumentate ospedalizzazioni [1]. A lungo il meccanismo patogenetico è rimasto poco chiaro, riflettendosi sulla scarsa disponibilità di terapie efficaci [2]. Tutt’oggi il fattore stimolante le colonie granulocitarie (G-CSF) costituisce l’unica opzione terapeutica approvata per la neutropenia nei pazienti con GSD Ib [3]. Se da un lato il G-CSF consente un rapido aumento dei neutrofili ed una riduzione del rischio di infezioni, la sua somministrazione può associarsi ad effetti collaterali quali splenomegalia ed ipersplenismo e rischio di sviluppare neoplasie mieloidi. Infine, alcuni pazienti mostrano soltanto una risposta parziale e possono richiedere dosi di G-CSF molto alte [4].
Patogenesi della neutropenia: ruolo dell’1,5AG6P
Recentemente è stato dimostrato il ruolo dell’accumulo intracellulare di 1,5-anidroglucitolo 6-fosfato (1,5AG6P) nella patogenesi della neutropenia nella GSD Ib. In tessuti che esprimono la glucosio 6-fosfatasi-β (G6Pasi-β, espressione ubiquitaria, gene G6PC3) ma non la G6Pasi-α (espressa principalmente in fegato, rene ed intestino, gene G6PC1) il G6PT trasporta il glucosio 6-fosfato ed il suo analogo strutturale 1,5AG6P ma non altri substrati. L’accumulo di 1,5AG6P è stato dimostrato in linee cellulari deficitarie in G6PT o G6Pasi-β incubate con il precursore 1,5AG, indicando che fisiologicamente l’1,5AG viene fosforilato a 1,5AG6P e che G6PT e G6Pasi-β sono necessari per l’idrolisi dell’1,5AG6P. Sulla base di tali osservazioni è stato quindi proposto il meccanismo patogenetico alla base della neutropenia/disfunzione neutrofila nella GSD Ib [5]. L’1,5AG (o 1-deossiglucosio) è una molecola (strutturalmente simile al glucosio) normalmente presente in circolo, prevalentemente di derivazione dietetica (origina dalla conversione dell’1,5-anidrofruttosio da parte di diverse glucosidasi).
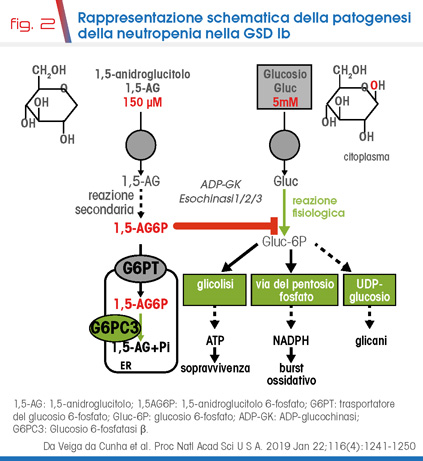 Una piccola quota (<10%) è prodotta a livello endogeno. L’1,5AG ha una lunga emivita (circa 3 mesi) in parte dovuta al suo riassorbimento a livello renale ad opera di diversi trasportatori tubulari (es. SGLT4, SGLT2), per i quali compete col glucosio. Nelle cellule (es. cellule ematopoietiche) viene fosforilato ad 1,5AG6P ad opera della glucochinasi ADP-dipendente (ADPCK) e di esochinasi a bassa affinità. Fisiologicamente, l’1,5AG6P è trasportato dal G6PT nel reticolo endoplasmico (ER) dove è defosforilato dalla G6Pasi-. In presenza di un difetto del G6PT (o della G6Pasi-), l’1,5AG6P si accumula in elevate concentrazioni nel citosol, inibendo le esochinasi. Questo risulta in una deplezione del pool intracellulare di G6P, con riduzione di glicolisi (n.b. i neutrofili maturi, essendo poveri in mitocondri, dipendono prevalentemente dalla glicolisi per la produzione di ATP), via del pentosio fosfato (attraverso cui si produce il NADPH utilizzato per il burst ossidativo nei neutrofili) e della glicosilazione delle proteine (per la quale è necessario l’UDP-glucosio) (Fig. 2). L’insieme di queste alterazioni impatta sulla sopravvivenza e il funzionamento dei neutrofili (e probabilmente anche dei macrofagi) [5].
Una piccola quota (<10%) è prodotta a livello endogeno. L’1,5AG ha una lunga emivita (circa 3 mesi) in parte dovuta al suo riassorbimento a livello renale ad opera di diversi trasportatori tubulari (es. SGLT4, SGLT2), per i quali compete col glucosio. Nelle cellule (es. cellule ematopoietiche) viene fosforilato ad 1,5AG6P ad opera della glucochinasi ADP-dipendente (ADPCK) e di esochinasi a bassa affinità. Fisiologicamente, l’1,5AG6P è trasportato dal G6PT nel reticolo endoplasmico (ER) dove è defosforilato dalla G6Pasi-. In presenza di un difetto del G6PT (o della G6Pasi-), l’1,5AG6P si accumula in elevate concentrazioni nel citosol, inibendo le esochinasi. Questo risulta in una deplezione del pool intracellulare di G6P, con riduzione di glicolisi (n.b. i neutrofili maturi, essendo poveri in mitocondri, dipendono prevalentemente dalla glicolisi per la produzione di ATP), via del pentosio fosfato (attraverso cui si produce il NADPH utilizzato per il burst ossidativo nei neutrofili) e della glicosilazione delle proteine (per la quale è necessario l’UDP-glucosio) (Fig. 2). L’insieme di queste alterazioni impatta sulla sopravvivenza e il funzionamento dei neutrofili (e probabilmente anche dei macrofagi) [5].
Nuove strategie terapeutiche
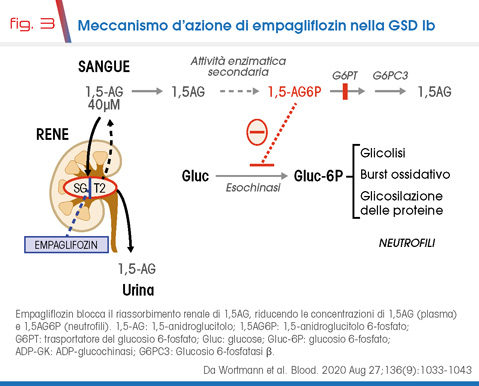 La dimostrazione del ruolo dell’accumulo intracellulare di 1,5AG6P nella patogenesi della neutropenia/disfunzione neutrofila costituisce la base per lo sviluppo di nuove strategie terapeutiche per la GSD Ib. Come detto, l’1,5AG (precursore dell’1,5AG6P) è prevalentemente di origine dietetica. Considerata la sua presenza in molti alimenti, limitarne l’ingestione rappresenta una strategia poco applicabile, soprattutto nei pazienti con GSD Ib che di per sé già necessitano di una dieta specifica. Si sono quindi esplorati trattamenti che aumentino l’escrezione urinaria di 1,5AG.
La dimostrazione del ruolo dell’accumulo intracellulare di 1,5AG6P nella patogenesi della neutropenia/disfunzione neutrofila costituisce la base per lo sviluppo di nuove strategie terapeutiche per la GSD Ib. Come detto, l’1,5AG (precursore dell’1,5AG6P) è prevalentemente di origine dietetica. Considerata la sua presenza in molti alimenti, limitarne l’ingestione rappresenta una strategia poco applicabile, soprattutto nei pazienti con GSD Ib che di per sé già necessitano di una dieta specifica. Si sono quindi esplorati trattamenti che aumentino l’escrezione urinaria di 1,5AG.
Fisiologicamente il glucosio filtrato attraverso il glomerulo renale è completamente riassorbito a livello tubulare mediante diversi trasportatori. Tra questi, il principale è SGLT2, espresso a livello del tubulo prossimale, che riassorbe circa l’80-90% del glucosio filtrato. Gli inibitori di SGLT2 (empagliflozin, canagliflozin, dapagliflozin) sono farmaci ipoglicemizzanti orali approvati per il trattamento del diabete tipo 2 che inibiscono il riassorbimento renale di glucosio. Poiché la glicosuria riduce il riassorbimento renale di 1,5AG (glucosio e 1,5AG competono per gli stessi trasportatori) è attesa una riduzione delle concentrazioni di 1,5AG (plasma) e 1,5AG6P (neutrofili). L’efficienza con cui il SGLT2 viene bloccato e la selettività per SGLT2 varia tra le diverse molecole (es. empagliflozin è il piu’ selettivo, canagliflozin è il meno selettivo per SGLT2) [6]. La riduzione di 1,5AG6P rimuove il blocco delle esochinasi e aumenta la disponibilità di G6P per i pathway che da esso originano, quali glicolisi (sintesi di ATP), via del pentosio fosfato (sintesi di NADPH necessario per il burst ossidativo) e glicosilazione delle proteine (per la quale è necessario UDP-glucosio), determinando aumentata sopravvivenza e migliorata funzione dei neutrofili (Fig. 3).
In topi G6PC3−/− trattati con empagliflozin si è osservata una riduzione >80% dei livelli di 1,5AG (plasma) e 1,5AG6P (neutrofili) ed un aumento dei neutrofili circolanti, in assenza di significative variazioni della glicemia [5]. Questi dati suggeriscono il possibile ruolo terapeutico degli inibitori di SGLT2 nei pazienti con GSD Ib.
Sulla base di questi risultati, 4 pazienti (3 femmine, 1 maschio, età: 2-21 anni) affetti da GSD Ib (tutti in terapia con G-CSF) sono stati trattati con empagliflozin (0.3-0.7 mg/Kg/die).
Recentemente sono stati pubblicati i risultati relativi al follow-up di circa 8 mesi (range: 6.4-9.6 mesi).
In nessun paziente si sono verificate ipoglicemie gravi. Dopo 3 settimane di trattamento si è osservata in tutti una riduzione di 4-5x delle concentrazioni plasmatiche di 1,5AG. In 3/4 pazienti è stata valutata anche la concentrazione leucocitaria di 1,5AG6P, evidenziandosi una riduzione >50% tra 15 e 30 giorni di trattamento. In tutti i pazienti si è osservata una riduzione delle fluttuazioni della conta dei neutrofili. In 2/4 pazienti il numero di neutrofili circolanti è rimasto stabile o aumentato anche dopo la sospensione del G-CSF; in 2/4 pazienti la conta dei neutrofili è rimasta stabile o aumentata anche dopo la riduzione della dose di G-CSF, rispettivamente dell’81% e del 57%. In 1/4 pazienti è stato valutato anche il burst ossidativo dei neutrofili, osservando un aumento dal 34% al 96% (rispetto ai controlli sani) dopo 2 giorni di trattamento. Similmente, l’attività battericida dei neutrofili valutata in 2/4 pazienti dopo l’inizio della terapia con empagliflozin è risultata sovrapponibile a quella dei controlli sani.
Infine, in 2/4 pazienti si è osservato un significativo miglioramento dello stato di glicosilazione della proteina LAMP2 nei granulociti [7].
Conclusioni e prospettive future
Da oltre 30 anni il G-CSF costituisce l’unica opzione terapeutica per la neutropenia/disfunzione neutrofila nella GSD Ib. Tuttavia, esso presenta diversi limiti legati al fatto di non agire direttamente sulla causa della neutropenia.
La definizione del meccanismo patogenetico alla base della neutropenia/disfunzione neutrofila nella GSD Ib ha consentito di identificare un farmaco che si è dimostrato efficace in vitro ed in vivo replicando in questo modo il percorso ideale (dal laboratorio al letto del malato) della medicina traslazionale. Nel caso specifico, l’identificazione di un farmaco già presente in commercio ne ha accelerato l’applicazione clinica.
Così come in passato la nutrizione enterale, l'amido di mais, il G-CSF, oggi gli inibitori di SGLT2 si propongono come potenzialmente in grado di modificare la storia naturale e migliorare il trattamento e la qualità di vita dei pazienti con GSD Ib.
I loro principali vantaggi sono la pronta disponibilità (sono già in commercio per la terapia del diabete tipo 2), la semplicità di assunzione (disponibili sottoforma di compresse), il costo (inferiore al G-CSF) ed un buon profilo di sicurezza. Sebbene i dati preclinici appaiano estremamente promettenti, l’esperienza clinica è ancora limitata e diversi aspetti restano da chiarire.
Non in tutti i pazienti è possibile sospendere la somministrazione di G-CSF. Non è chiaro se dosi maggiori rispetto a quelle utilizzate finora siano ugualmente (o maggiormente) sicure ed efficaci. Non è chiaro se empagliflozin sia sicuro e/o efficace anche nei pazienti con malattia renale. Empagliflozin potrebbe essere efficace anche su altre manifestazioni della GSD Ib (es. MICI, controllo metabolico). Inoltre, sebbene non si siano registrati episodi di ipoglicemia grave, essa (insieme alle infezioni delle vie urinarie) rappresenta un potenziale effetto collaterale (secondario alla glicosuria); quindi, l'inizio della somministrazione di questi farmaci e la stabilizzazione terapeutica dovrebbero avvenire in ambiente adeguato. Pertanto, piuttosto che configurarsi come un trattamento unico e risolutivo, verosimilmente questi farmaci arricchiranno l’armamentario terapeutico per i pazienti con GSD Ib ottimizzandone l’outcome.
È quindi necessario raccogliere ulteriori dati circa il profilo di sicurezza ed efficacia di empagliflozin nei pazienti con GSD Ib. In questo senso, lo sviluppo di un network collaborativo globale appare di fondamentale importanza. A tale scopo, l’Università di Groningen (Paesi Bassi) coordina iniziative per supportare lo sviluppo di una rete internazionale e finalizzate alla diffusione della conoscenza di questo argomento attraverso seminari, webinar ed incontri con le associazioni di pazienti. In particolare, è stato realizzato un sistema elettronico (database REDCap) per la raccolta dei dati relativi al follow-up di pazienti con GSD Ib trattati con empagliflozin.
Tutti gli interessati possono inviare una mail a t.g.j.derks@umcg.nl e alessandro.rossi@unina.it
Bibliografia
- Kishnani PS, Austin SL, Abdenur JE, et al. Diagnosis and management of glycogen storage disease type I: a practice guideline of the American College of Medical Genetics and Genomics. Genet Med. 2014;128:1-29.
- Jun HS, Weinstein DA, Lee YM, Mansfield BC, Chou JY. Molecular mechanisms of neutrophil dysfunction in glycogen storage disease type Ib. Blood. 2014;123(18):2843-2853.
- Visser G, Rake J, Labrune P, et al. Consensus guidelines for management of glycogen storage disease type 1b - European Study on Glycogen Storage Disease Type 1. Eur J Pediatr. 2003;161:S120-S123.
- Dale DC, Bolyard AA, Marrero T, et al. Neutropenia in glycogen storage disease Ib: outcomes for patients treated with granulocyte colony-stimulating factor. Curr Opin Hematol. 2019;26:16–21.
- Veiga-da-Cunha M, Chevalier N, Stephenne X, et al. Failure to eliminate a phosphorylated glucose analog leads to neutropenia in patients with G6PT and G6PC3 deficiency. Proc Natl Acad Sci U S A. 2019;116(4):1241-1250.
- Johnston R, Uthman O, Cummins E, et al. Canagliflozin, dapagliflozin and empagliflozin monotherapy for treating type 2 diabetes: systematic review and economic evaluation. Health Technol Assess 2017;21(2):1-218.
- Wortmann SB, Van Hove JLK, Derks TGJ,et al. Treating neutropenia and neutrophil dysfunction in glycogen storage disease IB with an SGLT2-inhibitor. Blood. 2020;136(9):1033-1043.





