Epatite autoimmune | L’epatite autoimmune è una rara patologia...
L’epatite autoimmune è una rara patologia autoimmune del...
L’epatite autoimmune (EA) è una rara patologia autoimmune del fegato, caratterizzata da presentazione clinica aspecifica ed eterogenea. L’EA può evolvere a cirrosi, insufficienza epatica e morte, in particolare se non riconosciuta e trattata precocemente. Si possono distinguere due tipologie di EA: il tipo 1 e il tipo 2. Il tipo 1 è più comune ed è caratterizzato da positività per gli autoanticorpi antinucleo (ANA) e anti muscolo liscio (anti-SMA); si può presentare a qualsiasi età con esordio clinico e istologico variabile e ha alti tassi di risposta terapeutica. L’EA di tipo 2 rappresenta il 10% di tutte le forme di EA, ha come elemento caratterizzante la positività agli autoanticorpi anti-LKM1 ed è quasi esclusiva dell’età pediatrica. Se comparata all’EA di tipo 1 è gravata da prognosi peggiore, con minore responsività alla terapia e più frequente necessità di terapia di mantenimento a lungo termine (1).
Epidemiologia
L’EA è una malattia rara, sebbene in Italia manchi ancora di un riconoscimento ufficiale come tale. L’EA ha una prevalenza variabile stimata di 15-25 casi per 100.000 abitanti. L’incidenza di EA è in progressivo aumento, con stime provenienti da registri danesi di aumento da 1,3 (1994) a 2,1 (2012) casi per 100.000 abitanti-anno (2). Come per altre patologie autoimmuni, il 75-80% dei pazienti affetti da EA sono di sesso femminile. L’EA di tipo 1 interessa pazienti di tutte le età; diversamente, l’EA di tipo 2 interessa soprattutto bambini, anche con età inferiore all’anno, e adolescenti/giovani adulti di età inferiore ai 25 anni, mentre è estremamente rara in individui di età superiore ai 25 anni (2).
Eziopatogenesi
L’eziopatogenesi della EA è sconosciuta; si ritiene che l’interazione tra un fattore ambientale non identificato e un individuo geneticamente predisposto determini una cascata di eventi immunologici che sostengono una infiammazione epatica cronica. La predisposizione genetica è confermata dalla presenza di una maggior incidenza di queste patologie tra familiari. La maggiore correlazione genetica è data dall’associazione con la regione genetica HLA (human leukocyte antigen), che suggerisce la verosimile centralità dei linfociti T CD4 nella sua patogenesi. I fattori ambientali che agiscono come innesco in pazienti predisposti sono verosimilmente agenti virali e/o xenobiotici (es. farmaci). Questo fenomeno di cross-reazione è chiamato mimetismo molecolare e si attiva quando la risposta immune contro virus o xenobiotici si dirige anche contro antigeni self a causa della forte omologia. La rottura della tolleranza al self chiama in causa i linfociti T regolatori, che sono disfunzionali e presenti in numero molto minore nei pazienti con EA. Indipendentemente dal fattore di innesco, il danno immunologico è caratterizzato da un’attivazione delle cellule presentanti l’antigene epatiche specializzate, come le cellule di Kupffer e le cellule dendritiche, le quali processano e presentano sulla loro superficie l’antigene self ai linfociti T recettori (TCR), con un progressivo perpetuarsi della risposta infiammatoria e della citotossicità epatica.
Presentazione clinica e quadro biochimico
La presentazione clinica dei pazienti con EA è eterogenea. La maggior parte dei pazienti è asintomatica o presenta sintomatologia aspecifica (astenia, calo ponderale, anoressia, poliartralgia). Non rara è la presentazione acuta, con epatite e ittero; molto rara è la presentazione fulminante con coagulopatia e encefalopatia epatica, gravata da elevata morbidità e mortalità. Un terzo dei pazienti presenta già alla diagnosi segni di cirrosi epatica. Il quadro biochimico tipico dei pazienti affetti da EA è caratterizzato da fluttuazioni spontanee dei livelli delle transaminasi (ALT e AST). I livelli di bilirubina possono essere normali o aumentati a seconda della gravità della condizione del paziente (2). Il livello sierico delle IgG è elevato nell’85% dei pazienti al momento della diagnosi (3). A scopo diagnostico è fondamentale la rilevazione degli autoanticorpi: ANA e anti-SMA (per EA tipo 1) e anti-LKM1 (per EA tipo 2). ANA e anti-SMA non sono patognomonici di EA; per converso, l’associazione tra la contemporanea positività ad ANA e anti-SMA aumenta significativamente la probabilità di EA nel contesto di un adeguato quadro clinico-patologico. Gli anti-LKM1, sono invece segno distintivo dell’EA di tipo 2 (4).
Istologia
Il ruolo della biopsia epatica nell’iter diagnostico della EA è essenziale, perché consente di rilevare elementi istologici tipici, di escludere altre patologie e di stadiare il grado di fibrosi (5). La caratteristica istologica più tipica è l’epatite di interfaccia, un infiltrato infiammatorio costituito da linfociti e plasmacellule presente a livello periportale che si estende al lobulo e spesso associato a necrosi. Sebbene presente in praticamente tutti i casi di EA cronica, questo quadro non è patognomonico potendosi rilevare anche in corso di altre patologie come epatiti virali, malattia di Wilson, danno da farmaci e malattie autoimmuni delle vie biliari. Altri reperti tipici sono le rosette epatiche, espressione di rigenerazione epatica, e l’emperipolesi, che consiste nella presenza di linfociti o plasmacellule all’interno del citoplasma epatocitario. I quadri ad esordio acuto e iperacuto hanno spesso caratteristiche differenti e più aspecifiche (6).
Diagnosi
 La diagnosi di EA non si avvale di un test patognomonico ma è affidata alla contemporanea presenza di diversi elementi clinici, biochimici, sierologici (autoanticorpi) e istologici, unitamente all’esclusione di patologie concomitanti (Tab. 1). L’indagine radiologica non ha un ruolo diagnostico ma è utile per escludere un overlap con la colangite sclerosante primitiva o a fini di stadiazione. L’EA spesso viene diagnosticata assieme ad altre patologie autoimmuni, in particolare tireopatie autoimmuni e connettiviti sistemiche.
La diagnosi di EA non si avvale di un test patognomonico ma è affidata alla contemporanea presenza di diversi elementi clinici, biochimici, sierologici (autoanticorpi) e istologici, unitamente all’esclusione di patologie concomitanti (Tab. 1). L’indagine radiologica non ha un ruolo diagnostico ma è utile per escludere un overlap con la colangite sclerosante primitiva o a fini di stadiazione. L’EA spesso viene diagnosticata assieme ad altre patologie autoimmuni, in particolare tireopatie autoimmuni e connettiviti sistemiche.
Trattamento
Il trattamento farmacologico d’elezione è rappresentato dalla terapia a base di steroide e/o farmaci immunosoppressori. Tale terapia ha come scopo biologico la riduzione dell’attività linfocitica e conseguentemente dell’infiammazione epatica; tale effetto biologico si traduce clinicamente nella risoluzione dei sintomi (qualora presenti), nella normalizzazione delle transaminasi e del livello di IgG sieriche (remissione biochimica). La risposta biochimica migliora la sopravvivenza dei pazienti e si associa a risoluzione della flogosi epatica a livello istologico con stabilità/miglioramento della fibrosi (remissione istologica) nella maggior parte dei casi (7) (Fig. 2).
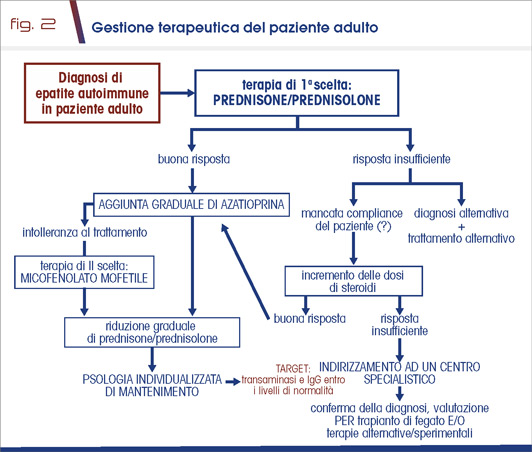 La terapia per l’EA è efficace in una percentuale maggiore all’80% dei pazienti, a prezzo tuttavia di effetti collaterali fisici e psichici, frequenti e talora anche gravi. Tali effetti collaterali sono principalmente correlati all’uso cronico dei farmaci immunosoppressori, con i noti effetti negativi sul metabolismo glucidico, lipidico, sul metabolismo osseo, e correlati all’aumentato rischio di infezioni opportunistiche e di neoplasie. Nei casi complessi sono utilizzati in seconda e terza linea il micofenolato mofetile, gli inibitori delle calcineurine (tacrolimus, ciclosporina), o farmaci biologici quali rituximab o infliximab (8). Il trapianto è riservato ai casi di epatite acuta fulminante con encefalopatia e nei pazienti con cirrosi epatica scompensata, secondo le linee guida nazionali e internazionali e i protocolli definiti dalla rete dei centri trapianto (9,10).
La terapia per l’EA è efficace in una percentuale maggiore all’80% dei pazienti, a prezzo tuttavia di effetti collaterali fisici e psichici, frequenti e talora anche gravi. Tali effetti collaterali sono principalmente correlati all’uso cronico dei farmaci immunosoppressori, con i noti effetti negativi sul metabolismo glucidico, lipidico, sul metabolismo osseo, e correlati all’aumentato rischio di infezioni opportunistiche e di neoplasie. Nei casi complessi sono utilizzati in seconda e terza linea il micofenolato mofetile, gli inibitori delle calcineurine (tacrolimus, ciclosporina), o farmaci biologici quali rituximab o infliximab (8). Il trapianto è riservato ai casi di epatite acuta fulminante con encefalopatia e nei pazienti con cirrosi epatica scompensata, secondo le linee guida nazionali e internazionali e i protocolli definiti dalla rete dei centri trapianto (9,10).
Conclusioni
L’EA è una patologia rara dall’eziopatogenesi ancora oscura, caratterizzata da una presentazione eterogenea e un iter diagnostico complesso. Le terapie disponibili sono efficaci ma gravate da importanti effetti collaterali. L’EA va sospettata da tutti i clinici al fine di evitare ritardi diagnostici, ma la sua gestione va riservata a centri epatologici di secondo e terzo livello.
Bibliografia
- Bossen L, Gerussi A, Lygoura V, et al. Support of precision medicine through risk-stratification in autoimmune liver diseases – histology, scoring systems, and non-invasive markers. Autoimmun. Rev. 2018; 17(9):854–865.
- Mieli-Vergani G, Vergani D, Czaja AJ, et al. Autoimmune hepatitis. Nat Rev Dis Primers. 2018; 12; 4:18017.
- Hartl J, Miquel R, Zachou K, et al. Features and outcome of AIH patients without elevation of IgG. JHEP Rep. 2020 Feb 29;2(3):100094.
- Gerussi A, Halliday N, Carbone M, et al. Open challenges in the management of autoimmune hepatitis. Minerva Gastroenterol. Dietol. 2020 Dec. 03 doi:10.23736/S1121-421X.20.02805-6
- Tiniakos DG, Brain JG, Bury YA. Role of Histopathology in Autoimmune Hepatitis. Dig. Dis. 2015; 33(2): 53–64.
- Rahim MN, Miquel R, Heneghan MA. Approach to the patient with acute severe autoimmune hepatitis. JHEP Rep. 2020;2(6):100149.
- Gerussi A, Halliday N, Saffioti F, et al. Normalization of serum immunoglobulin G levels is associated with improved transplant-free survival in patients with autoimmune hepatitis. Dig. Liver Dis. 2020;52(7):761-767.
- Lohse AW, Sebode M, Jørgensen MH, et al. Second-line and Third-line therapy for Autoimmune Hepatitis A position statement from the European Reference Network on Hepatological Diseases and the International Autoimmune Hepatitis Group. J Hepatol. 2020;73(6):1496-1506.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Autoimmune hepatitis. J Hepatol. 2015;63(4):971-1004.
- Mack CL, Adams D, Assis DN, et al. Diagnosis and Management of Autoimmune Hepatitis in Adults and Children: 2019 Practice Guidance and Guidelines From the American Association for the Study of Liver Diseases. Hepatology. 2020;72(2):671-722.





