Esperienza clinica nell’uso di una terapia orale di prima linea...
La malattia di Gaucher di tipo 1 (GD1) è un disordine da accumulo...
La malattia di Gaucher di tipo 1 e i principali approcci terapeutici
La malattia di Gaucher di tipo 1 (GD1) è un disordine da accumulo lisosomiale, la cui causa è un deficit nell’attività dell’enzima β-glucosidasi acida, che porta ad un accumulo di glucosilceramide (GL-1) nei macrofagi tissutali, soprattutto a livello di milza, fegato e midollo osseo. Le conseguenze cliniche sono condizioni debilitanti e progressive quali anemia, trombocitopenia, epatosplenomegalia e alterazioni del metabolismo osseo [1].
Esistono due approcci alternativi per trattare la malattia di Gaucher di tipo 1, che agiscono in modo diverso ma con lo stesso scopo di bloccare l’accumulo di glucosilceramide nelle cellule. La terapia enzimatica sostitutiva (enzyme replacement therapy, ERT) è una terapia infusionale volta a compensare l’attività enzimatica endogena nel paziente per migliorare la degradazione delle glucosilceramidi.
La terapia di riduzione del substrato (substrate replacement therapy, SRT) è un trattamento orale, che inibisce l’enzima glucosilceramide sintetasi, rallentando così la produzione di glucosilceramidi e riequilibrando la formazione del substrato con la sua degradazione [2,3].
Eliglustat - inibitore specifico della glucosilceramide sintetasi - rappresenta l’unica terapia orale di prima linea per i pazienti adulti affetti da GD1.
Prima di iniziare il trattamento, i pazienti devono effettuare un test per determinare la velocità di metabolizzazione del farmaco nell’organismo, analizzando il genotipo del citocromo P450 2D6 (CYP2D6), in quanto ci sono polimorfismi nel gene che modificano la rapidità di metabolizzazione del farmaco e condizionano, pertanto, la dose terapeutica [4]. Eliglustat non deve essere utilizzato in metabolizzatori ultra-rapidi o indeterminati per CYP2D6; fortunatamente più del 90% dei pazienti con GD1 hanno uno stato di metabolizzatore CYP2D6 compatibile con l’uso del farmaco (metabolizzatori estensivi, intermedi o lenti) [1].
Efficacia e sicurezza della terapia orale: risultati a 8 anni
Il programma di sviluppo clinico del farmaco ha previsto l’arruolamento di circa 400 pazienti in 29 paesi, in diversi trials. I risultati a 8 anni dello studio di fase II e l’estensione dei due studi registrativi di fase III hanno confermato che l’efficacia e la sicurezza di eliglustat sono paragonabili a quelle della ERT. La maggior parte delle reazioni avverse è risultata lieve e transitoria; quella segnalata più frequentemente è la dispepsia, in circa il 6% dei pazienti partecipanti agli studi clinici [5]. Uno studio clinico di estensione attualmente in corso (ELISAFE) confermerà la sicurezza del farmaco nel lungo periodo.
Studio di fase II
Lo studio multicentrico di fase II, open-label, a braccio singolo, ha valutato l’efficacia e la sicurezza di eliglustat (50 o 100 mg due volte al giorno) in pazienti adulti con GD1 mai trattati. Alla settimana 52 i pazienti hanno potuto continuare lo studio nella fase di estensione.
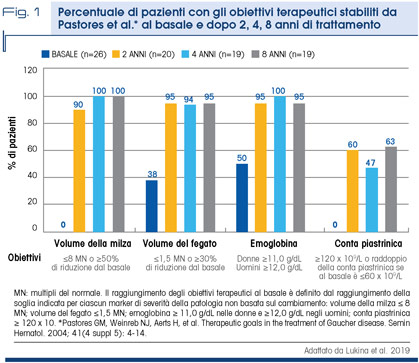 Tutti i pazienti, indipendentemente dalla gravità della malattia al basale, hanno raggiunto alla settimana 52 almeno 3 dei 4 obiettivi terapeutici stabiliti per i pazienti in trattamento a lungo termine con ERT. I miglioramenti nei parametri, raggiunti nei pazienti già dal primo anno, sono stati mantenuti durante 8 anni di trattamento (Fig. 1).
Tutti i pazienti, indipendentemente dalla gravità della malattia al basale, hanno raggiunto alla settimana 52 almeno 3 dei 4 obiettivi terapeutici stabiliti per i pazienti in trattamento a lungo termine con ERT. I miglioramenti nei parametri, raggiunti nei pazienti già dal primo anno, sono stati mantenuti durante 8 anni di trattamento (Fig. 1).
Il valore medio di T-score lombare si è spostato da un range di osteopenia ad un range di normalità nei primi 4 anni di trattamento ed è rimasto normale durante i restanti 4 anni dello studio. I biomarcatori del GD1 si sono ridotti di oltre l’85% e la riduzione si è mantenuta stabile fino all’ottavo anno [6,7].
Studio di fase III: ENGAGE
Lo studio ENGAGE di fase III, randomizzato, in doppio cieco e controllato con placebo, ha valutato l’efficacia e la sicurezza di eliglustat (50 o 100 mg due volte al giorno) per 9 mesi in 40 pazienti naïve alla ERT.
Dopo 9 mesi di terapia i pazienti trattati con eliglustat, in confronto a quelli trattati con placebo, hanno visto ridursi significativamente il volume splenico rispetto al basale (endpoint primario). Inoltre, sono stati raggiunti gli endpoint secondari con un miglioramento significativo di volume epatico, dei valori di emoglobina e conta piastrinica vs placebo a 9 mesi.
Nella fase di estensione open-label, tutti i pazienti che hanno continuato ad assumere la terapia orale (39 su 40) hanno evidenziato ulteriori miglioramenti nel volume degli organi e nei parametri ematologici. Inoltre è stato osservato un trend di miglioramento per la funzionalità del midollo osseo e per tutti i marker di malattia ossea, rispetto al placebo [8].
Studio di fase III: ENCORE
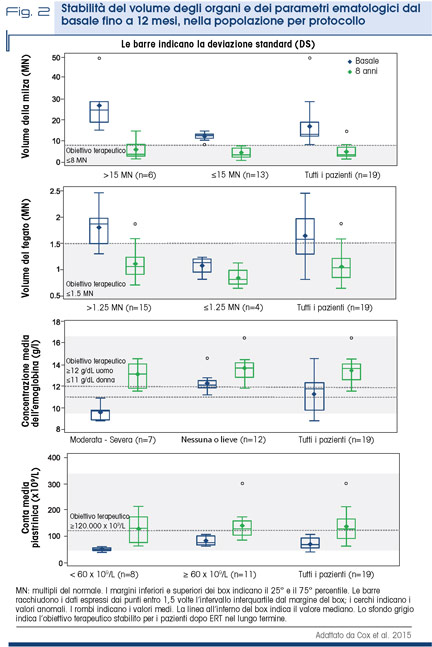 Lo studio multicentrico ENCORE ha analizzato l’efficacia di eliglustat nel mantenere la stabilità della malattia in pazienti già in trattamento con ERT da almeno 3 anni. I pazienti sono stati randomizzati 2:1 a ricevere eliglustat o imiglucerasi (ERT); dopo 12 mesi di trattamento, l’85% dei pazienti trattati con eliglustat e il 94% dei pazienti in trattamento con imiglucerasi hanno raggiunto l’endpoint composito primario, con valori che hanno dimostrato la non inferiorità di eliglustat rispetto alla ERT (differenza tra i gruppi pari a -8,8%; IC 95%: -17,6; 4,2) (Fig. 2) [9].
Lo studio multicentrico ENCORE ha analizzato l’efficacia di eliglustat nel mantenere la stabilità della malattia in pazienti già in trattamento con ERT da almeno 3 anni. I pazienti sono stati randomizzati 2:1 a ricevere eliglustat o imiglucerasi (ERT); dopo 12 mesi di trattamento, l’85% dei pazienti trattati con eliglustat e il 94% dei pazienti in trattamento con imiglucerasi hanno raggiunto l’endpoint composito primario, con valori che hanno dimostrato la non inferiorità di eliglustat rispetto alla ERT (differenza tra i gruppi pari a -8,8%; IC 95%: -17,6; 4,2) (Fig. 2) [9].
Al termine del periodo in doppio cieco, i pazienti avevano accesso ad una fase di estensione in open-label in cui venivano tutti trattati con eliglustat. I valori medi della concentrazione di emoglobina, della conta piastrinica, del volume splenico e del fegato sono rimasti stabili per oltre 4 anni. I livelli plasmatici dei biomarcatori (GL-1 e GM3 ganglioside), nel range di normalità già al basale, si riducevano di un ulteriore 50% dopo i primi 3 mesi di trattamento; questa riduzione veniva mantenuta a 4 anni. La qualità di vita si manteneva sostanzialmente stabile a lungo termine. Nello stesso studio, i T-score e Z-score della densità minerale ossea (BMD), a livello lombare e femorale, sono stati mantenuti nell’intervallo di normalità fino a 4 anni nei pazienti trattati [10]. Più recentemente, durante il 15th Annual WORLD Symposium™ 2019 (Orlando, Florida), un’analisi che ha preso in considerazione 393 pazienti trattati con eliglustat per 4-8 anni (studi di fase II e III) ha mostrato come, non solo nei pazienti naïve ci sia un miglioramento dei parametri ossei valutati, quanto nei pazienti precedentemente trattati con ERT si confermi una stabilità o un miglioramento degli stessi. Queste evidenze suggeriscono che la terapia orale possa essere un’opzione efficace per il trattamento delle manifestazioni ossee di GD1 [11].
I dati real world e la popolazione pediatrica
I risultati real world a 2 anni, raccolti sia in pazienti naïve che in pazienti che hanno effettuato uno switch terapeutico da ERT, risultano coerenti con quelli riportati negli studi clinici [12]. È in fase di arruolamento lo studio ELIKIDS (NCT03485677), multicentrico e open-label, che valuterà efficacia e sicurezza di eliglustat (in monoterapia o in combinazione con imiglucerasi) in pazienti di età compresa tra 6 e 17 anni.
Esperienza real life presso la Fondazione Ca’ Granda Policlinico di Milano
L’emergenza sanitaria per il COVID-19 ha messo a dura prova i presidi ospedalieri e minimizzare gli accessi in ospedale costituisce un’esigenza sia per le strutture sanitarie sia per i pazienti. In questo contesto, la terapia orale può offrire un indubbio vantaggio, in particolare in quelle zone dove non è disponibile l’infusione domiciliare, in quanto il paziente non necessita di recarsi in ospedale ogni 14 giorni. La genotipizzazione preventiva assume quindi una più ampia valenza, anche al fine di non precludere al paziente un possibile passaggio alla SRT.
Presso la UOC Medicina Generale - Centro Malattie Rare della Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico - sono attualmente seguiti 24 pazienti adulti affetti da GD1. Fino a qualche anno fa tutti i pazienti venivano sottoposti a terapia ERT infusionale, presso il centro o al domicilio.
Dal 2018 ad oggi 16 pazienti sono stati testati per il genotipo del CYP2D6; l’analisi ha rivelato che tutti i pazienti sono candidabili al trattamento orale, non avendo riscontrato metabolizzatori ultra-rapidi o casi indeterminati.
Il test è stato proposto in occasione della visita periodica a tutti i pazienti candidabili, per caratteristiche cliniche, allo switch alla terapia orale; il test è poi stato effettuato su richiesta del paziente stesso. Tra i soggetti testati, 8 pazienti sono poi passati alla SRT.
Le scelte che hanno spinto i pazienti a tale passaggio sono state soprattutto correlate al poter proseguire la propria vita quotidiana svincolati dall’infusione periodica: alcuni pazienti abitano fuori città ed in zone più isolate e hanno così ridotto la necessità di raggiungere periodicamente l’ospedale, altri avevano invece limitazioni di orari o necessità di permanenza all’estero per periodi prolungati per esigenze lavorative.
Alcuni pazienti hanno invece preferito la periodica infusione alla necessità di assumere il farmaco quotidianamente.
Una paziente sta valutando la pianificazione di una gravidanza ed è stato pertanto rimandato il cambio di terapia, ma è già stata testata per il CYP2D6.
Due pazienti hanno dovuto sospendere la terapia a circa 6 mesi dall’inizio per effetti collaterali: un paziente con importante disidrosi ricomparsa al rechallenge della terapia e un paziente con alvopolideposto in quadro di nota sindrome dell’intestino irritabile, diventato invalidante.
Quattro pazienti stanno assumendo la terapia, 3 dei quali da più di 18 mesi, con buona aderenza e tolleranza.
Uno dei pazienti, già in terapia orale da più di un anno, ha presentato un ulteriore miglioramento della conta piastrinica, con completa normalizzazione, con l’introduzione della SRT. Due pazienti hanno introdotto la terapia orale prima dell’emergenza sanitaria per COVID-19; il farmaco ad oggi risulta ben tollerato e non sono stati segnalati eventi avversi.
Durante l’emergenza non è stato necessario apportare modifiche delle terapie in corso, grazie alla possibilità di avviare ad infusione domiciliare tutti i pazienti che in precedenza si recavano periodicamente presso il centro per l’infusione. La possibilità di passare al trattamento con eliglustat potrebbe offrire un ulteriore vantaggio, quello di limitare la presenza di personale sanitario a domicilio, necessario per il monitoraggio della terapia infusionale. Aver già effettuato la genotipizzazione del CYP2D6 ci permetterà a breve un più rapido passaggio a tale terapia.
Pertanto, un approccio personalizzato al paziente che deve iniziare o che deve adattare/rivedere la propria terapia per la GD1, in base anche alle proprie esigenze di vita, deve ad oggi tener conto della disponibilità di eliglustat, farmaco a somministrazione orale con ormai dimostrato buon profilo sia di tolleranza che di efficacia.
Bibliografia
- Peterschmitt MJ, Cox GF, Ibrahim J, et al. A pooled analysis of adverse events in 393 adults with Gaucher disease type 1 from four clinical trials of oral eliglustat: Evaluation of frequency, timing, and duration. Blood Cells Mol Dis 2018;68:185-91.
- Belmatoug N, Di Rocco M, Fraga C, et al. Management and monitoring recommendations for the use of eliglustat in adults with type 1 Gaucher disease in Europe. Eur J Intern Med 2017;37:25-32.
- Scott LJ. Eliglustat: A review in Gaucher disease Type 1. Drugs 2015;75(14):1669-78.
- Cerdelga. Riassunto delle caratteristiche del prodotto. Disponibile all’indirizzo: http://www.ema.europa.eu
- Peterschmitt MJ, Freisens S, Underhill LH et al. Long-term adverse event profile from four completed trials of oral eliglustat in adults with Gaucher disease type 1. Orphanet J Rare Dis. 2019 Jun 7; 14(1): 128.
- Lukina E, Watman N, Dragosky M, et al. Outcomes after 8 years of eliglustat therapy for Gaucher disease type 1: Final results from the phase 2 trial. Am J Hematol 2019;94(1):29-38.
- Lukina E, Watman N, Arreguin EA et al. Improvement in hematological, visceral, and skeletal manifestations of Gaucher disease type 1 with oral eliglustat tartrate (Genz-112638) treatment: 2-year results of a phase 2 study. Blood 2010;116(20):4095-8.
- Mistry PK, Lukina E, Ben Turkia H, et al. Effect of oral eliglustat on splenomegaly in patients with Gaucher disease type 1: The ENGAGE randomized clinical trial. JAMA 2015;313(7):695-706.
- Cox TM, Drelichman G, Cravo R, et al. Eliglustat compared with imiglucerase in patients with Gaucher’s disease type 1 stabilised on enzyme replacement therapy: A phase 3, randomised, open-label, non-inferiority trial. Lancet 2015;385(9985):2355-62.
- Cox TM, Drelichman G, Cravo R, et al. Eliglustat maintains long-term clinical stability in patients with Gaucher disease type 1 stabilized on enzyme therapy. Blood 2017;129(17):2375-83.
- Cox TM, Charrow J, Lukina E. Effects of oral eliglustat on skeletal manifestations in patients with type 1 Gaucher disease: Results from four completed clinical trials after long-term treatment. Poster presentation. 15th Annual WORLD Symposium. Orlando 2019.
- Mistry PK, Balwani M, Charrow J. Two years of efficacy of oral eliglustat in treatment-naïve and switch patients enrolled in the International Collaborative Gaucher Group Gaucher Registry. Poster presentation.




