I difetti congeniti del metabolismo intracellulare della vitamina...
I pazienti con difetti del metabolismo intracellulare della...
La vitamina B12 o cobalamina (Cbl) è una vitamina idrosolubile che l'uomo non è in grado di sintetizzare e deve assumere tramite gli alimenti di origine animale. Assorbita a livello intestinale, viene trasformata nelle sue forme metabolicamente attive, la metilcobalamina (MeCbl) e l’adenosilcobalamina (AdoCbl), cofattori rispettivamente dell'enzima metilmalonil-CoA mutasi, responsabile della trasformazione dell’acido metilmalonico (MMA) in succinil-CoA, e dell'enzima metionina sintasi che converte l'omocisteina (HC) in metionina (Met).
Il difetto congenito di uno di questi enzimi determina, quindi, un impedimento alla trasformazione della vitamina B12 nelle sue forme metabolicamente attive. Ne consegue il blocco della sua attività di cofattore, con accumulo nel plasma e nelle urine di MMA e/o HC, e ridotta sintesi di Met. Ad oggi sono noti 7 difetti, denominati: CblC, D, E, F, G, J e X. La forma più frequente tra questi difetti è rappresentata da CblC (80%); i deficit di CblD, E, F e G rappresentano meno del 5% ognuno, Cbl J e X sono i più rari (meno dell'1%).
Epidemiologia
Le linee guida europee sui deficit di rimetilazione del 1998 riportavano a livello mondiale 42 casi descritti di CblC/D e 13 casi di CblE/G. Nel 2006, anno in cui sono stati chiariti gli aspetti genetici della malattia, il numero di casi era 250. Oggi, con l’introduzione dello screening neonatale esteso, si stima una prevalenza compresa tra 1:60.000-1:100.000 nuovi nati. Per gli altri difetti, più rari, ancora non esistono dati precisi.
Genetica
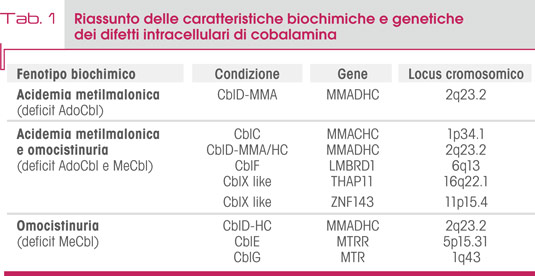 Ad eccezione del difetto di CbIX, che presenta una trasmissione X-linked, tutti gli altri casi riconoscono una modalità di trasmissione autosomico recessiva (Tab. 1).
Ad eccezione del difetto di CbIX, che presenta una trasmissione X-linked, tutti gli altri casi riconoscono una modalità di trasmissione autosomico recessiva (Tab. 1).
Il deficit di CblC è dovuto a mutazioni del gene MMACHC (locus 1p34.1) con conseguenti alterazioni dell’omonima proteina (MMACHCp, Methylmalonic aciduria and homocystinuria type C protein). Le più frequenti sono le mutazioni c.271dupA (30% dei casi) e c.331C>T e la c.394C>T. Numerosi studi hanno cercato di delineare una correlazione genotipo-fenotipo e, anche se il quadro non è del tutto definito, sono state evidenziate mutazioni connesse con il tipo di esordio: le mutazioni c.271dupA e c.331C>T in omozigosi o eterozigosi composta sono associate ad esordio early onset, mentre c.394C>T e c.482G>A in omozigosi o eterozigosi composta sono associate alla forma late onset. La mutazione classica c.271dupA in eterozigosi composta con c.394C>T, c.347T>C e c.482G>A può dare un fenotipo late onset.
CblD, CblE, CblF, CblG, CblJ e CblX sono causate rispettivamente da mutazioni dei geni MMADHC, MTRR, MBRD1, MTR, ABCD4 e HCFC1. Sono stati riportati singoli casi di fenotipi CblX-like associati a mutazioni dei geni THAP11 e ZNF143. La forma CblD, in base alla posizione della mutazione nel gene, può essere associata a 3 distinti fenotipi biochimici: una forma con omocistinuria isolata (CblD-HC), una con metilmalonica acidemia isolata (CblD-MMA) e una con entrambe (CblD-MMA/HC). Per quanto riguarda gli altri difetti: la mutazione c.1361C>T del gene MTRR che determina la forma CblE è associata ad un fenotipo mild senza coinvolgimento neurologico, mentre per le altre forme (CblF, G, J e X) non sono state descritte chiare correlazioni.
Eziopatogenesi
Una volta assorbita, per svolgere la sua funzione di cofattore la vitamina B12 deve essere attivata ad adenosilcobalamina (AdoCbl) e metilcobalamina (MeCbl). L’AdoCbl è necessaria per il funzionamento dell’enzima mitocondriale metilmalonil-CoA mutasi (Mut), che catalizza l’isomerizzazione del metilmalonil-CoA a succinil-CoA. La MeCbl è, invece, essenziale per il funzionamento della metionina sintasi (MS), che rigenera la metionina (Met) dalla omocisteina e demetila il 5-metiltetraidrofolato a tetraidrofolato (ciclo dei folati). La rigenerazione di Met è critica perché permette il perpetuarsi del ciclo di S-adenosil-metionina (SAM), donatore di metili necessario per molte reazioni biologiche. Inoltre MS mantiene bassi livelli di omocisteina e adeguati livelli di tetraidrofolato.
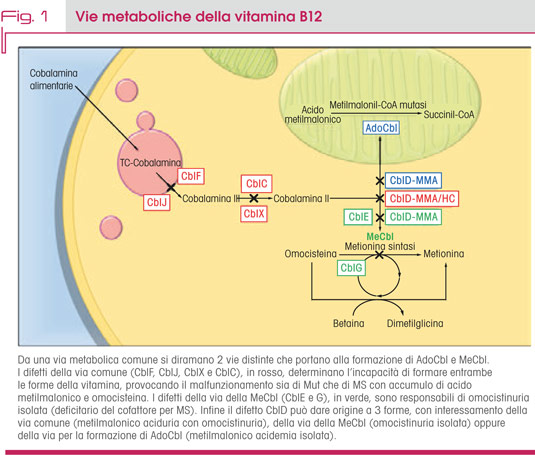 In figura 1 sono schematizzate le vie metaboliche le cui alterazioni sono responsabili dei difetti congeniti del metabolismo intracellulare della vitamina B12.
In figura 1 sono schematizzate le vie metaboliche le cui alterazioni sono responsabili dei difetti congeniti del metabolismo intracellulare della vitamina B12.
Manifestazioni cliniche
I pazienti con difetti del metabolismo intracellulare della vitamina B12 presentano un fenotipo eterogeneo legato all’età di esordio (early onset e late onset) con coinvolgimento multi sistemico. CblC è la forma più comune e il suo fenotipo rappresenta pertanto il prototipo dei difetti combinati di rimetilazione quali CblD-MMA/HC, CblF, CblJ. I quadri clinici sono spesso indistinguibili e sovrapponibili a quelli riscontrati nei difetti isolati di rimetilazione quali CblD-HC, CblE e CblG.
Raramente la malattia può esordire con un’idrope fetale, ritardo di crescita intrauterino (IUGR), malformazioni cardiache congenite e cardiomiopatia dilatativa. Possono associarsi microcefalia e alterazioni dismorfiche (facies allungata, filtro piatto e padiglioni auricolari a impianto basso).
La tipica presentazione early onset, progressiva e letale se non trattata tempestivamente, è caratterizzata all’esordio da IUGR, difficoltà di alimentazione, ritardo di crescita, ipotonia. Il quadro clinico può essere complicato dallo sviluppo di sindrome emolitico uremica (SEU), deterioramento neurologico con convulsioni, encefalopatia acuta con iperammoniemia e acidosi. Un danno oculare con maculopatia, retinopatia e atrofia del nervo ottico si sviluppa nella maggior parte degli individui anche in terapia.
Le forme late onset esordiscono nei primi anni di vita, in età adolescenziale o adulta. I bambini possono presentare scarso accrescimento, anemia megaloblastica con citopenia, microangiopatia trombotica renale e SEU, ipertensione polmonare. E’ presente un ritardo globale dello sviluppo associato o meno a convulsioni, encefalopatia e ipotonia. In adolescenza ed età adulta i pazienti possono avere solo interessamento renale e polmonare e possono essere stati in precedenza asintomatici o avere una storia di difficoltà emotive e/o di apprendimento, ematuria, proteinuria, anemia o trombosi ricorrenti non spiegate. Se presente un coinvolgimento del SNC, questo può associare segni e sintomi neurologici e psichiatrici: neuropatia periferica e atassia (da degenerazione subacuta del midollo spinale), disturbi della personalità, anomalie comportamentali acute o croniche, deterioramento cognitivo. A volte è presente un coinvolgimento oculare, simile a quello delle forme early onset.
Diagnosi
La diagnosi di primo livello è di tipo biochimico. Nei difetti di CblC, D-MMA/HC, F, J, X il pattern è caratterizzato da interessamento in entrambe le vie e pertanto da: aumentato livello dell’omocisteina totale plasmatica (tHC > 50 -100 µM/L), metionina normale o ridotta, riscontro di omocistinuria e metilmalonico aciduria. Nelle forme CblD-HC, E e G con interessamento limitato alla via dell'omocisteina si trova un aumentato livello dell’omocisteina totale plasmatica (tHC), una metionina normale o ridotta ed omocistinuria. Infine, il difetto di CblD-MMA determina una metilmalonico aciduria isolata.
La diagnosi differenziale di iperomocisteinemia comprende alcune malattie acquisite carenziali (B12, folati, B6) e non (autoimmuni, trattamenti farmacologici). Tra le cause congenite abbiamo il deficit di cistationina beta-sintasi (ipermetioninemia) e mutazioni MTHFR (ipometioninemia con MMA normale). Va segnalato che i livelli di MMA non sono elevati come nei casi di deficit di MMA-mutasi, in cui si avrà normale omocisteina, aumento dell’ammoniemia e una sintomatologia da intossicazione.
L’analisi genetica completa l’inquadramento diagnostico ed è utile per una possibile diagnosi prenatale in caso di successive gravidanze, sia su villi che su liquido amniotico. In mancanza di dati molecolari è possibile eseguire la diagnosi con analisi di complementazione su amniociti e/o con dosaggio della concentrazione di MMA e tHC nel liquido amniotico.
L’era dello screening neonatale
L’introduzione dello screening neonatale esteso (SNE) con metodica tandem-massa ha reso possibile rilevare questi difetti in fase presintomatica. Nei difetti che coinvolgono la via dell’acido metilmalonico si riscontra un aumento di propionilcarnitina (C3) e del rapporto C3/C2 (propionil/acetilcarnitina). La specificità aumenta se si dosa come second tier test l’acido metilmalonico. I difetti che coinvolgono la via della metilcobalamina vedono, invece, una riduzione della concentrazione di metionina. Utile anche il rapporto metionina/fenilalanina e come second tier test l’omocisteina totale.
Principi di terapia
Obiettivi della terapia sono il miglioramento delle condizioni cliniche, la normalizzazione della metionina sierica, l’abbassamento di omocisteina e dell’acido metilmalonico.
Per tutti i difetti, nella fase acuta, la terapia consiste nella somministrazione parenterale di vitamina B12. L'idrossicobalamina ad alte dosi è risultata più efficace della cianocobalamina nei difetti di CblC; la stessa formulazione è indicata anche negli altri difetti. La dose abitualmente usata nei neonati è di 1 mg/die. Un aumento, su base individuale, del dosaggio può essere indicato. Nella fase di mantenimento la somministrazione intramuscolare è preferita a quella orale, ottimizzando la frequenza delle iniezioni sulla base della risposta del paziente.
Nei difetti che determinano omocistinuria è necessaria la somministrazione di betaina che induce una rimetilazione dell’omocisteina accumulata in metionina attraverso la via betaina-omocisteina metiltransferasi nel fegato. Il farmaco ha una emivita breve e deve essere suddiviso in 3-4 dosi/die per via orale. La dose iniziale è di 250 mg/kg/die (dose massima 20 gr/die) ma poi va trovata la dose minima efficace. Va ricordato che la betaina determina un aumento della metionina che a livelli molto alti (>1000 umol/L) può causare edema cerebrale acuto. Nel caso di CblC è consigliato associare acido folico o folinico e, in caso di deficit di carnitina libera, levocarnitina ad un dosaggio di 50-200 mg/kg/die. La dieta ipoproteica o con basso apporto di metionina è sconsigliata dalle recenti linee guida sia nei difetti di CblC negli altri disordini di rimetilazione.
Negli esordi acuti va mantenuto un adeguato apporto calorico e idrico per via endovenosa per il rischio di disidratazione e va monitorato l’equilibrio elettrolitico.
Il riconoscimento e il trattamento precoce dei difetti CblC nei pazienti early onset consente di prevenire alcune complicanze severe quali la SUE, l’idrocefalo e le anomalie ematologiche. E’ invece incerto l’impatto della terapia precoce sullo sviluppo neurocognitivo e poco efficace sulla patologia oculare. Nella maggior parte dei pazienti late onset la terapia si è dimostrata capace di migliorare la funzione renale ed i sintomi neurologici e psichiatrici. In corso di terapia i parametri biochimici, pur migliorando, non raggiungono mai valori normali. Va, infine, ricordato che in caso di procedure anestesiologiche, in questi pazienti non si deve utilizzare l’ossido nitrico perché può causare la deplezione di vitamina B12 e inibire l’enzima metionina sintasi.
Conclusioni
I difetti del metabolismo intracellulare della B12 sono malattie metaboliche parzialmente trattabili. Il trattamento precoce è verosimilmente utile a ridurre la morbilità anche se ad oggi la letteratura ancora non è uniforme sui reali effetti delle diverse dosi e vie di somministrazione. Anche se abbiamo imparato tanto dai pazienti affetti da queste patologie, ci mancano ancora conoscenze fisiopatologiche dettagliate, soprattutto per comprendere le cause del ritardo mentale e del danno oculare: futuri studi ci potranno aiutare in merito e forse dare nuovi strumenti per prevenirli.
Bibliografia
- Coelho D, Suormala T, Stucki M, et al. Gene Identification for the cblD Defect of Vitamin B12 Metabolism. N Engl J Med 2008;358:1454-64.
- Fischer S, Huemer M, Baumgartner, et al. Clinical presentation and outcome in a series of 88 patients with the CblC defect. Journal of Inherited Metabolic Disease, 2014; 37(5), 831–840.
- Huemer M, Bürer C, Ješina P, et al. Clinical onset and course, response to treatment and outcome in 24 patients with the cblE or cblG remethylation defect complemented by genetic and in vitro enzyme study data. Journal of Inherited Metabolic Disease, 2015; 38(5), 957–967.
- Huemer M, Diodato D, Schwahn B, et al. Guidelines for diagnosis and management of the cobalamin-related remethylation disorders cblC, cblD, cblE, cblF, cblG, cblJ and MTHFR deficiency. Journal of Inherited Metabolic Disease, 2017; 40(1), 21–48.
- Huemer M, Kozich V, Rinaldo P, et al. Newborn screening for homocystinurias and methylation disorders: systematic review and proposed guidelines. Journal of Inherited Metabolic Diseas, 2015; 38(6), 1007–1019.
- Nogueira C, Marcao A, Rocha H, et al. Molecular picture of cobalamin C/D defects before and after newborn screening era. Journal of Medical Screening, 2016; 0(0), 1–6.
- Ogier de Baulny H, Gerard M, Saudubray JM, et al. Remethylation defects: guidelines for clinical diagnosis and treatment. European Journal of Pediatrics, 1998; 157:S77-83.
- Sloan JL, Carrillo N, Adams D, et al. Disorders of Intracellular Cobalamin Metabolism. Gene Review, 2018. Sito verificato in data 18 dicembre 2018
- Stucki M, Coelho D, Suormala T, et al. Molecular mechanisms leading to three different phenotypes in the cblD defect of intracellular cobalamin metabolism. Human Molecular Genetics, 2012; 21, No. 6.




