I tumori ereditari del colon-retto: la sindrome di Lynch | La...
La sindrome di Lynch è una malattia genetica ad ereditarietà...
La sindrome di Lynch (LS) è una malattia genetica ad ereditarietà autosomica dominante che comporta una predisposizione multi-organo allo sviluppo di tumori. Nota in precedenza come Tumore ereditario del colon-retto non poliposico (HNPCC), la malattia prende il suo nome dal medico statunitense Henry T. Lynch che studiò dagli anni ‘60 il legame tra genetica e sviluppo di tumori (1). La prima descrizione della malattia risale però al 1915 quando Aldred S. Whartin pubblicò la storia oncologica di un nucleo familiare con forte ricorrenza di tumori dell’endometrio, dello stomaco e del colon con caratteristiche evocative della trasmissione di una malattia ereditaria (2).
La sindrome è causata dalla presenza di varianti patogenetiche in eterozigosi che determinano la perdita di funzione di uno dei quattro geni codificanti le proteine principali del sistema di riparazione degli errori accaduti durante la sintesi del DNA (MLH1, MSH2, MSH6, PMS2) (3). Raramente, la perdita di funzione di MSH2 è dovuta alla delezione terminale del gene fiancheggiante EPCAM responsabile dello “spegnimento” del promotore di MSH2 e della formazione di un trascritto di fusione tra i due geni (4).
Il mismatch repair, la sua firma molecolare e le implicazioni terapeutiche
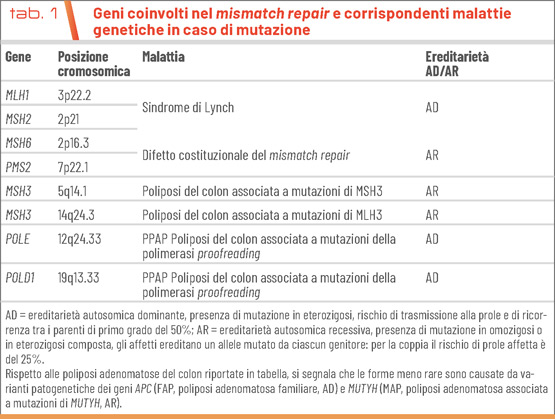 Il sistema enzimatico di correzione degli errori di inserimento delle basi azotate (mismatch repair, MMR) entra in funzione non appena si è completata la sintesi del filamento di DNA nascente grazie al complesso MSH2-MSH6 che scorre lungo la doppia elica arrestandosi in presenza di una qualsiasi distorsione. Viene quindi reclutato il complesso MLH1-PMS2 che a sua volta promuove l’eliminazione del breve tratto di filamento nascente contenente l’errore e la re-sintesi ad opera delle DNA polimerasi e (POLE) e d1 (POLD1): partecipano al mismatch repair altre proteine accessorie i cui geni sono riportati in tabella 1 insieme alle malattie genetiche di cui sono responsabili.
Il sistema enzimatico di correzione degli errori di inserimento delle basi azotate (mismatch repair, MMR) entra in funzione non appena si è completata la sintesi del filamento di DNA nascente grazie al complesso MSH2-MSH6 che scorre lungo la doppia elica arrestandosi in presenza di una qualsiasi distorsione. Viene quindi reclutato il complesso MLH1-PMS2 che a sua volta promuove l’eliminazione del breve tratto di filamento nascente contenente l’errore e la re-sintesi ad opera delle DNA polimerasi e (POLE) e d1 (POLD1): partecipano al mismatch repair altre proteine accessorie i cui geni sono riportati in tabella 1 insieme alle malattie genetiche di cui sono responsabili.
I soggetti affetti da LS, con mutazione germinale in eterozigosi, non presentano alcuna manifestazione clinica finché nelle cellule somatiche non accade casualmente il cosiddetto second-hit, ovvero la perdita di funzione dell’allele normale per mutazione somatica. In queste cellule, completamente prive di una delle quattro proteine MMR, la mancata correzione degli errori accaduti durante la sintesi del DNA determina l’accumulo progressivo di mutazioni somatiche (sostituzioni, delezioni, inserzioni di uno o pochi nucleotidi) anche a carico di oncogeni e geni onco-soppressori, che promuove la trasformazione neoplastica.
I tumori causati dalla perdita di funzione del MMR presentano delle caratteristiche peculiari che rappresentano la “firma molecolare” del difetto che li ha generati:
- perdita di espressione della proteina corrispondente al gene mutato (MSH6 o PMS2 per le mutazioni dei rispettivi geni) o del complesso proteico (MSH2-MLH6 e MLH1-PMS2 rispettivamente per le mutazioni di MSH2 o di MLH1) rilevabile con analisi immuno-istochimica su preparati istologici
- instabilità dei microsatelliti, ovvero l’accorciamento o l’allungamento delle brevi ripetizioni di nucleotidi sparse nel genoma umano, rilevabile con un test molecolare su DNA estratto da sezioni istologiche di tessuto tumorale
- alto carico mutazionale (High Molecular Tumor Burden) ovvero la presenza di 20-50 mutazioni ogni milione di nucleotidi rilevabile con i test molecolari di sequenziamento di nuova generazione finalizzati alla “profilazione” genetica dei tumori.
L’elevato numero di mutazioni puntiformi nelle cellule tumorali con difetto del MMR determina l’espressione di neo-antigeni che stimolano una vivace risposta immunitaria: ciò spiega l’infiltrato linfocitario tipico dei tumori causati dalla LS e una prognosi relativamente più favorevole. Lo stimolo continuo dei linfociti T ne determina però l’esaurimento funzionale indotto dall’aumento di espressione di PD-1 (Programmed cell Death protein 1) il cui ligando PD-L1 è espresso dai macrofagi, dai linfociti e dalle stesse cellule tumorali. Il legame tra PD-1 e PD-L1 attenua la risposta immunitaria anti-tumorale ma rappresenta il bersaglio molecolare di farmaci mirati (anticorpi monoclonali contro il recettore o il ligando) che manifestano la loro efficacia nei tumori con attivazione del checkpoint immunitario (5).
Le manifestazioni cliniche della sindrome di Lynch
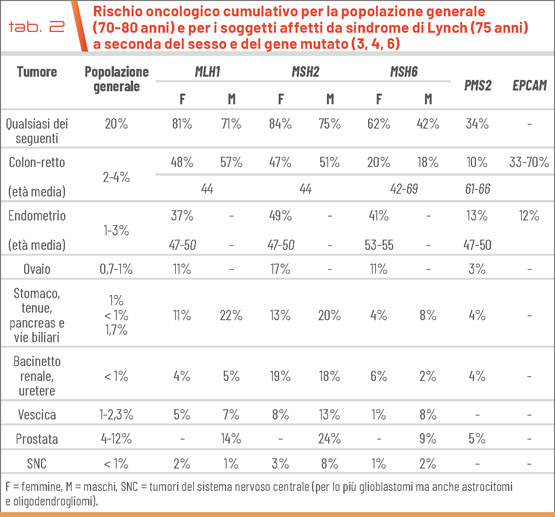 La malattia comporta un significativo aumento del rischio di sviluppare tumori del tratto gastro-enterico (colon, retto, stomaco, intestino tenue), dell’endometrio e delle ovaie (per lo più tumori endometrioidi o misti con componente mucinosa e a cellule chiare), dell’epitelio transizionale delle alte vie urinarie, del pancreas, delle vie biliari, della prostata e della vescica. Più raramente possono osservarsi adenomi e carcinomi delle ghiandole sebacee (sindrome di Muir-Torre), tumori cerebrali (sindrome di Turcot), sarcomi e carcinomi della corteccia surrenale (Tab. 2) (3, 6).
La malattia comporta un significativo aumento del rischio di sviluppare tumori del tratto gastro-enterico (colon, retto, stomaco, intestino tenue), dell’endometrio e delle ovaie (per lo più tumori endometrioidi o misti con componente mucinosa e a cellule chiare), dell’epitelio transizionale delle alte vie urinarie, del pancreas, delle vie biliari, della prostata e della vescica. Più raramente possono osservarsi adenomi e carcinomi delle ghiandole sebacee (sindrome di Muir-Torre), tumori cerebrali (sindrome di Turcot), sarcomi e carcinomi della corteccia surrenale (Tab. 2) (3, 6).
Le varianti patogenetiche dei geni MSH2 e MLH1 causano una predisposizione allo sviluppo di tumori ad alta penetranza con sviluppo prima dei 50 anni di tumori del colon, dell’endometrio e dell’ovaio. La sorveglianza clinica e le polipectomie eseguite durante le colonscopie periodiche aumentano la probabilità di guarigione dei suddetti tumori cui spesso segue lo sviluppo delle neoplasie meno frequenti con mortalità entro i 75 anni del 19-24% (MSH2) e del 15-16% (MLH1). La malattia causata dalle mutazioni di MSH6 presenta una penetranza inferiore e un’età di insorgenza più tardiva, si manifesta maggiormente nel sesso femminile (tumori dell’endometrio e dell’ovaio) e comporta una mortalità entro i 75 anni del 6-9%.
Il difetto costituzionale del mismatch repair
Più raro della sindrome di Lynch, il difetto costituzionale del mismatch repair è una malattia recessiva che si osserva in età pediatrica nei soggetti omozigoti (o eterozigoti composti) per varianti patogenetiche in uno dei quattro geni MMR. La malattia comporta lo sviluppo nell’infanzia di sarcomi, leucemie, linfomi e tumori cerebrali, seguito, nell’adolescenza e in età giovane adulta, dai tumori del colon, dell’endometrio e delle ovaie. La presenza di macchie cutanee pigmentate, seppure di maggiori dimensioni e in minor numero rispetto alla neurofibromatosi tipo 1, necessita di una diagnosi differenziale tra le due malattie (7).
Il coinvolgimento del MMR nei tumori sporadici: lo screening “universale” nei tumori del colon e dell’endometrio
Il 20-30% dei tumori dell’endometrio e il 15-20% dei tumori del colon-retto presentano un difetto del MMR rilevabile all’analisi immunoistochimica o al test di instabilità dei micro-satelliti. Nella maggior parte dei casi (80% circa) si osserva la perdita di espressione del complesso proteico MLH1-PMS2 dovuta alla iper-metilazione del promotore di MLH1 che causa lo “spegnimento” del gene, un evento somatico che non ha alcuna relazione con la LS.
Nei tumori del colon-retto, la metilazione del promotore di MLH1 è spesso indotta dalla mutazione somatica di BRAF p.Val600Glu (V600E) mentre nei tumori dell’endometrio la causa non è nota.
Data la sensibilità dei tumori con difetto di MMR ai farmaci mirati contro il checkpoint immunitario, tutti i casi di nuova diagnosi di tumore del colon e dell’endometrio vengono sottoposti a screening “universale” con analisi immunoistochimica su preparato istologico con la doppia finalità di fornire indicazioni utili ai fini terapeutici e di individuare i pazienti per i quali è appropriata una consulenza genetica e un test diagnostico per la LS.
Sono meritevoli di approfondimento tutti i casi che presentano la perdita di espressione:
- delle singole proteine MSH6 o PMS2, potenziali portatori di mutazioni nei corrispondenti geni
- del complesso MSH2-MSH6, potenziali portatori di mutazioni del gene MSH2
- del complesso MLH1-PMS2 in assenza di metilazione somatica del promotore di MLH1; se il test di metilazione non è disponibile: i pazienti affetti da tumore del colon negativi per la mutazione somatica di BRAF V600E, i pazienti affetti da tumore del colon o dell’endometrio prima dei 50 anni e con storia oncologica personale e/o familiare suggestiva della LS.
Conclusioni
Dallo screening universale dei tumori del colon-retto per i difetti del MMR ci si aspetta il riconoscimento dei casi incidenti di sindrome di Lynch, che tuttavia non esaurisce l’ambito delle predisposizioni ereditarie allo sviluppo di questi tumori che include le poliposi adenomatose e amartomatose del colon, altre forme multi-tumorali (geni NTHL1 e MBD4, entrambe recessive) e il raro tumore ereditario del colon da mutazioni dominanti del gene RPS20.
Bibliografia
- Lynch HT, Krush AJ, Larsen AL. Heredity and multiple primary malignant neoplasms: Six cancer families. Am J Med Sci. 1967;254:322-329.
- Warthin AS. Heredity with reference to carcinoma as shown by the study of the cases examined in the Pathological Laboratory of the University of Michigan, 1895–1912. Arch Intern Med. 1913;12:546-555.
- Møller P, Seppälä TT, Ahadova A, et al. Dominantly inherited micro-satellite instable cancer - the four Lynch syndromes - an EHTG, PLSD position statement. Hered Cancer Clin Pract. 2023;21:19.
- Ligtenberg MJL, Kuiper RP, Geurts van Kessel A, et al. EPCAM deletion carriers constitute a unique subgroup of Lynch syndrome patients. Familial Cancer. 2013;12:169-174.
- Schöniger S, Rüschoff J. Mismatch Repair Deficiency and Microsatellite Instability. Encyclopedia. 2022;2:1559-1576.
- Dominguez-Valentin M, Sampson JR, Seppälä TT, et al. Cancer risks by gene, age, and gender in 6350 carriers of pathogenic mismatch repair variants: findings from the Prospective Lynch Syndrome Database. Genet Med. 2020;22:15-25.
- Aronson M, Colas C, Shuen A, et al. Diagnostic criteria for constitutional mismatch repair deficiency (CMMRD): recommendations from the international consensus working group. J Med Genet. 2022;59:318-327.





