La sclerosi sistemica | La sclerosi sistemica è una malattia...
La sclerosi sistemica è una malattia cronica rara del tessuto...
La sclerosi sistemica (SSc) o sclerodermia, ovvero “pelle indurita”, dal greco σκληρός (duro) e δέρμα (pelle) è una malattia cronica rara del tessuto connettivo, ad eziologia multifattoriale, caratterizzata da alterazioni del sistema immunitario con produzione di autoanticorpi, disfunzione endoteliale e progressivo accumulo di tessuto fibroso a carico della cute e degli organi interni: apparato gastroenterico, cuore, polmone, rene. La prima descrizione risale al XVIII secolo da parte del medico Curzio da Napoli, ma il termine “sclerodermia” è molto più recente. L’accumulo di tessuto fibroso a carico degli organi rende la malattia invalidante con conseguente compromissione della qualità di vita del paziente. La sclerosi cutanea e l’atrofia muscolare caratteristiche della malattia causano severi cambiamenti nell’aspetto fisico, con un inevitabile impatto sulla sfera emotiva e sul benessere psicologico del paziente. Inoltre la SSc è caratterizzata da alterazioni microvascolari con disregolazione del tono vascolare, clinicamente evidente come fenomeno di Raynaud (FR), le “mani fredde” in oltre il 90% dei casi. Tali anormalità microcircolatorie sono le prime manifestazioni della SSc e possono precedere di mesi o anni il coinvolgimento cutaneo e viscerale. L’intero processo è caratterizzato da perdita dei capillari, con severe manifestazioni di ischemia periferica (soprattutto a livello delle mani) con formazione di ulcere digitali e gangrena (fino all’autoamputazione di falangi), causando così grave disabilità ai pazienti. Definita da W. Osler “the most terrible of all human diseases”; è infatti terribile, per il paziente, assistere all’avanzare della malattia, che altera i lineamenti del viso e le espressioni mimiche, diminuisce le capacità funzionale delle mani dove compaiono ulcere cutanee dolorose e necrotiche, limita l’autosufficienza del paziente e altera, inoltre, importanti funzioni d’organo.
Patogenesi
Le cause non sono ancora state identificate e i numerosi studi sulla genetica nella sua patogenesi non hanno portato a risultati esaustivi. Il fatto che gemelli monozigoti, ossia caratterizzati dallo stesso patrimonio genetico, possano essere discordanti per la SSc suggerisce che le cause di questa malattia siano da attribuire principalmente a fattori epigenetici, piuttosto che genetici. In particolare, analizzando i profili di metilazione del DNA di linfociti da sangue periferico di gemelli monozigoti discordanti per la malattia, sono state osservate differenze solo nei geni presenti sul cromosoma X. La SSc ha una predominanza femminile con un rapporto tra i due sessi di circa 12:1, il genere può quindi avere un ruolo determinante nello sviluppo di tale malattia. L’esordio avviene più frequentemente fra i 20 ed i 50 anni e l'incidenza è stimata tra i 4 e i 20 nuovi casi per 1.000.000 per anno.
Segni clinici
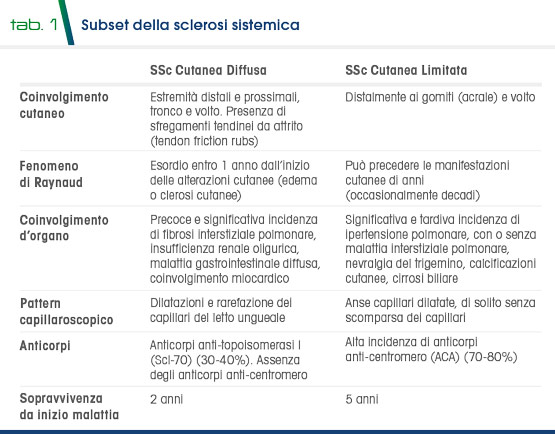
L’elemento caratterizzante la SSc che inizia con “le mani fredde”, è però il progressivo ispessimento ed indurimento della cute e del tessuto connettivo sottocutaneo, la cui estensione (valutata mediante il Rodnan Skin Score) consente di distinguere classicamente una forma limitata, (interessamento delle regioni distali degli arti superiori ed inferiori ed eventualmente del volto), ed una forma diffusa, che colpisce anche le regioni prossimali degli arti e del tronco (Tab. 1).
 Le principali cause di morte sono dovute al coinvolgimento polmonare, cardiaco (insufficienza cardiaca, aritmia ventricolare) e renale (crisi renale). L’interessamento polmonare, prima causa di morte si caratterizza in genere per la comparsa di un’interstiziopatia parenchimale associata o meno ad ipertensione arteriosa polmonare.
Le principali cause di morte sono dovute al coinvolgimento polmonare, cardiaco (insufficienza cardiaca, aritmia ventricolare) e renale (crisi renale). L’interessamento polmonare, prima causa di morte si caratterizza in genere per la comparsa di un’interstiziopatia parenchimale associata o meno ad ipertensione arteriosa polmonare.
Diagnosi
Negli ultimi anni si è comunque assistito ad una chiara riduzione della mortalità, con una sopravvivenza a 10 anni dell’80%-90% nei pazienti con la forma limitata e circa del 70% nella forma diffusa, grazie alle diagnosi in fasi sempre più precoci di malattia e ai numerosi farmaci utilizzati. Una diagnosi precoce è però fondamentale per avviare un trattamento che permetta di rallentare l’evoluzione della malattia ed evitare o ridurre i danni agli organi interni, individuando la “window of opportunity” fondamentale a trattare il paziente.
Segno distintivo della malattia è la presenza di autoanticorpi specifici, i principali dei quali infatti sono costituiti dagli anticorpi anti-topoisomerasi I e dagli anticorpi anti-centromero. Tuttavia un’alta percentuale dei pazienti SSc è sieronegativo a questi anticorpi, risultando positivo solo alla ricerca di anticorpi quali anti-Pm-Scl, anti-Th/To, anti-U3RNP/anti-fibrillarina e anti-RNA polimerasi I, II e III.
La diagnosi di SSc è piuttosto semplice nelle fasi di malattia conclamata, in cui l’impegno sclerotico della cute coesiste con il FR e con manifestazioni o reperti laboristico-strumentali di impegno degli organi interni. Fino a pochi anni fa, la diagnosi di SSc veniva effettuata in base ai criteri ACR 1980 (American College of Rheumatology) che richiedono la presenza di sclerosi cutanea prossimalmente alle articolazioni metacarpofalangee o metatarsofalangee, o di due dei tre criteri secondari (sclerodattilia, ulcere digitali, o fibrosi polmonare). Purtroppo questi criteri consentono una diagnosi solo in fasi caratterizzate da fibrosi tissutale, che è solo parzialmente reversibile e può portare a disfunzioni degli organi colpiti. Le Roy e Medsger, proposero i criteri per definire la SSc in una fase più precoce, come una condizione caratterizzata dal FR, in presenza di anticorpi antinucleari marcatori o di tipiche alterazioni capillaroscopiche (megacapillari e/o aree avascolari). Al fine di superare però il limite di una diagnosi sempre più precoce di malattia,si è cercato di identificare criteri che individuassero tale fase di malattia, requisito fondamentale al fine di prevenire l’evoluzione verso il danno d’organo irreversibile e invalidante. In quest’ottica si inserisce lo studio prospettico osservazionale multicentrico VEDOSS (Very Early Diagnosis Of Systemic Sclerosis) promosso da EUSTAR (European Scleroderma Trials And Reasearch Group) e iniziato nel marzo 2010 al fine di validare criteri per la diagnosi di SSc in fase molto precoce.
 Come necessari per la diagnosi di SSc in fase molto precoce sono stati identificati quattro segni/sintomi: presenza di FR, puffy fingers, autoanticorpi specifici per SSc (anti-centromero e anti-topoisomerasi I) e anomalie capillari compatibili con pattern sclerodermico alla capillaroscopia. Si tratta di Red Flags che devono far sospettare precocemente la presenza di SSc, e quindi inviare il paziente ad uno specialista.
Come necessari per la diagnosi di SSc in fase molto precoce sono stati identificati quattro segni/sintomi: presenza di FR, puffy fingers, autoanticorpi specifici per SSc (anti-centromero e anti-topoisomerasi I) e anomalie capillari compatibili con pattern sclerodermico alla capillaroscopia. Si tratta di Red Flags che devono far sospettare precocemente la presenza di SSc, e quindi inviare il paziente ad uno specialista.
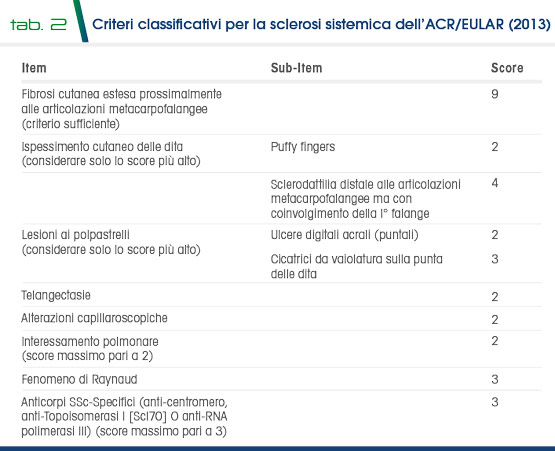
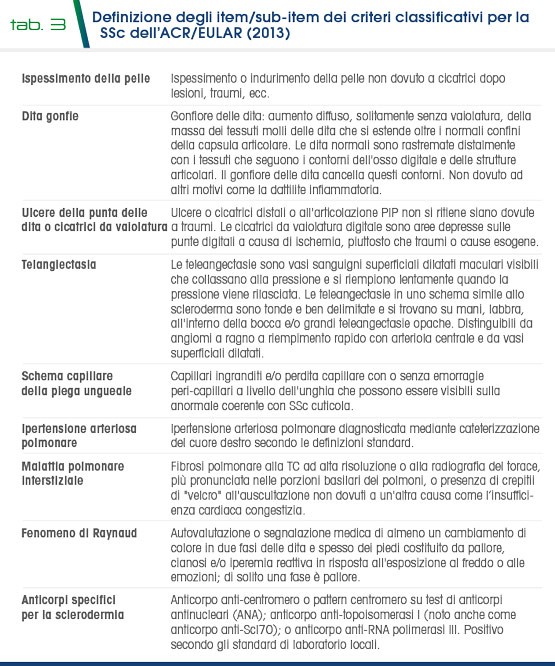
Nel 2013 infine, sono stati creati da ACR e da EULAR (European League Against Rheumatism) nuovi criteri classificativi per la SSc (Tab. 2 e Tab. 3), che prevedono la somma dei punteggi relativi agli item (ispessimento cutaneo delle dita, lesioni fingertip, teleangectasie, anomalie capillari del letto ungueale, pneumopatia interstiziale, FR, autoanticorpi SSc etc) che risultano positivi. I pazienti con punteggio ≥9 vengono classificati come affetti da SSc. Comunque, autoanticorpi e pattern videocapillaroscopico sono considerati principali strumenti diagnostici per indagare i pazienti in presenza di FR, nel sospetto di SSc in fase molto precoce di malattia.
 La videocapillaroscopia periungueale è il metodo più affidabile, non invasivo, facilmente ripetibile, per valutare sia la comparsa, sia la progressione dell’alterazione a livello della microcircolazione e quindi per distinguere precocemente tra FR primario e secondario a connettiviti.
La videocapillaroscopia periungueale è il metodo più affidabile, non invasivo, facilmente ripetibile, per valutare sia la comparsa, sia la progressione dell’alterazione a livello della microcircolazione e quindi per distinguere precocemente tra FR primario e secondario a connettiviti.
Follow-up
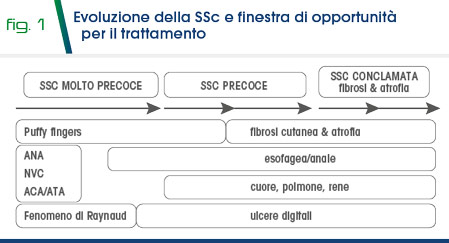
I pazienti che presentano le Red Flags (FR, edema digitale, capillaroscopia alterata, autoanticorpi specifici) dovrebbero essere sottoposti ad ulteriori indagini per valutare la funzione e lo status degli organi interni (ecocolordoppler cardiaco con misurazione delle pressioni polmonari, TC torace ad alta risoluzione, prove di funzionalità respiratoria con misurazione del DLCO, funzionalità renale delle 24 ore con valutazione della proteinuira e microalbuminuria ed elettroliti, dosaggio NT-proBNP etc). Ciò richiede una stretta collaborazione tra il reumatologo e i medici di medicina generale che devono essere pertanto adeguatamente formati a riconoscere tali Red Flags (Fig. 1).
 Essendo classificata come malattia rara sono stati istituiti diversi registri regionali che consentono la gestione dei dati relativi alle modalità di presentazione e la prescrizione di farmaci; inoltre il registro EUSTAR continua ad arruolare pazienti per progetti di ricerca scientifica ed epidemiologica, infine la SIR (Società Italiana di Reumatologia) ha creato un registro italiano della patologia volto a determinare l’incidenza a livello italiano e aperto allo sviluppo di progetti scientifici.
Essendo classificata come malattia rara sono stati istituiti diversi registri regionali che consentono la gestione dei dati relativi alle modalità di presentazione e la prescrizione di farmaci; inoltre il registro EUSTAR continua ad arruolare pazienti per progetti di ricerca scientifica ed epidemiologica, infine la SIR (Società Italiana di Reumatologia) ha creato un registro italiano della patologia volto a determinare l’incidenza a livello italiano e aperto allo sviluppo di progetti scientifici.
Il significato che questa patologia rara assume nella vita del paziente e della propria famiglia, è stata facilitata dallo studio delle opere dell’eclettico artista Paul Klee, affetto da SSc a metà degli anni Trenta del Novecento, rendendo possibile aggiungere tasselli importanti sulla parte emotiva della malattia, capendone, attraverso le sue opere, la tragedia.
Il medico deve saper comunicare con efficacia e con chiarezza con i pazienti e con i familiari, sia nella fase diagnostica, sia in quella della comunicazione della diagnosi, con particolare riguardo ai pazienti più giovani che al momento della diagnosi presentano solo le “mani fredde” e non sospettano invece, di avere una patologia che può cambiare per sempre la loro vita.
Bibliografia
- Chiffolt H. Fautrel B, Sordet C, Chateleu E, Sibilia J. Incidence and prevalence of systemic sclerosis: a systemic literature review . Semin Arhritis Rheum. 2008; 37(4) :223-235.
- Steen VD, Medseger TA. Changes in causes of death in systemic sclerosis,1972-2002.Annals of Rheumatic Diseases 2007;66:940-944.
- Valentini G, Matucci Cerinic M. Disease specific quality indicators, guidelines and outcome measures in scleroderma. Clin Exp Rheumatol 2007; 25 (47):159-162.
- Steen VD. Autoantibodies in systemic sclerosis. Semin Arthritis Rheum 2005; 35:35-42.
- Cutolo M, Pizzorni C, Tuccio M, et al. Nailfold videocapillaroscopic patterns and serum autoantibodies in systemic sclerosis. Rheumatology 2004; 43: 719-26.
- Hudson M, Thombs B, Baron M. Time to Diagnosis in Systemic Sclerosis: Is Gender a factor? Arthritis Rheum 2007;56:487-489.
- Guiducci S, Giacomelli R, Matucci Cerinic M. Vascular complications of scleroderma. Autoimmunity Rev 6 2007: 520-523.
- Matucci Cerinic M, Allanore Y, Czirják L, et al. The challenge of early systemic sclerosis for the EULAR Scleroderma Trial and Research group (EUSTAR) community. It is time to cut the Gordian knot and develop a prevention or rescue strategy. Ann Rheum Dis. 2009;68(9):1377–1380.
- Avouac J, Fransen J, Walker UA, et al. Preliminary criteria for the very early diagnosis of systemic sclerosis: results of a Delphi Consensus Study from EULAR Scleroderma Trials and Research Group. Ann Rheum Dis. 2011;70(3):476–481.
- van den Hoogen F, Khanna D, Fransen J, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative. Arthritis Rheum. 2013;65(11):2737-47.





