La sindrome di Smith-Magenis: fenotipo comportamentale e profilo...
La sindrome di Smith-Magenis è una malattia sporadica da...
La sindrome di Smith-Magenis (SMS) è una malattia genetica da delezione del cromosoma 17p11.2, regione che include il gene RAI1 la cui aploinsufficienza è responsabile della maggior parte delle caratteristiche proprie della condizione.
.jpg) Il fenotipo distintivo comprende dismorfismi craniofacciali, obesità, disturbo del sonno e del comportamento. Sono segni costanti la disabilità intellettiva di grado variabile e il disturbo del linguaggio.
Il fenotipo distintivo comprende dismorfismi craniofacciali, obesità, disturbo del sonno e del comportamento. Sono segni costanti la disabilità intellettiva di grado variabile e il disturbo del linguaggio.
Epidemiologia
La SMS è stata descritta per la prima volta nel 1986 da Anne Smith e Ellen Magenis [1]. La prevalenza segnalata è di 1:25000, ma si ipotizza una prevalenza pari a 1:15000, con un rapporto maschi e femmine pari a 1:1. Ad oggi sono noti più di 500 pazienti in tutto il mondo [2].
Eziologia
.jpg) Il 90% dei soggetti affetti da SMS presenta una delezione interstiziale de novo 17p11.2 di circa 3.5-5 Mb. Il restante 10% presenta mutazione del gene RAI1 (Fig. 1). Questi soggetti presentano solo occasionalmente malformazioni maggiori e bassa statura, sono percentualmente più obesi, ma hanno le stesse caratteristiche comportamentali, di fisionomia, di disturbo del sonno dei soggetti con delezione (Tab. 1).
Il 90% dei soggetti affetti da SMS presenta una delezione interstiziale de novo 17p11.2 di circa 3.5-5 Mb. Il restante 10% presenta mutazione del gene RAI1 (Fig. 1). Questi soggetti presentano solo occasionalmente malformazioni maggiori e bassa statura, sono percentualmente più obesi, ma hanno le stesse caratteristiche comportamentali, di fisionomia, di disturbo del sonno dei soggetti con delezione (Tab. 1).
Normalmente tali modificazioni genetiche sono de novo. Se l’analisi cromosomica è normale, il rischio di ricorrenza è basso, intorno all’1%, legato alla possibilità di mosaicismo germinale genitoriale [2]. Le analisi comportamentali condotte sul modello murino hanno dimostrato che la perdita pan-neurale di RAI-1 provoca deficit nelle funzioni motorie e nell'apprendimento e un’inadeguata condotta alimentare [3]. Oggi si ipotizza che RAI1 abbia effetti su un network multiplo di geni (CLOCK, BDNF...) la cui espressione variabile influenzerebbe lo spettro fenotipico della SMS [4].
Diagnosi
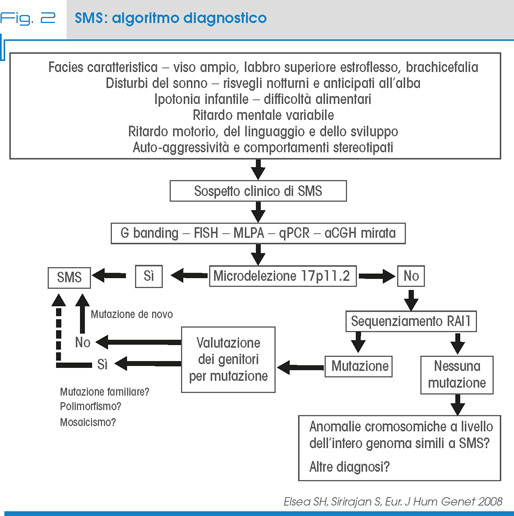 Nel sospetto clinico di SMS è indicata l’esecuzione della ibridazione fluorescente in situ (FISH) con sonde che includano RAI1 o array CGH (Fig. 2). Se questi sono negativi ed esiste un forte sospetto deve essere considerato il sequenziamento del gene RAI1.
Nel sospetto clinico di SMS è indicata l’esecuzione della ibridazione fluorescente in situ (FISH) con sonde che includano RAI1 o array CGH (Fig. 2). Se questi sono negativi ed esiste un forte sospetto deve essere considerato il sequenziamento del gene RAI1.
Caratteristiche cliniche
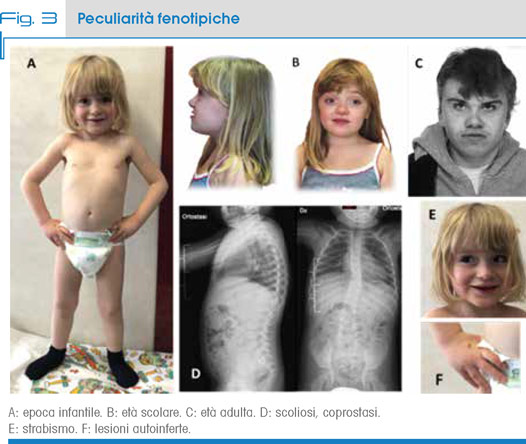
Il fenotipo dei soggetti SMS è riconoscibile grazie a specifiche caratteristiche fisiche, evolutive e comportamentali (Tab. 1). L’aspetto del viso è caratterizzato da una faccia ampia di forma quadrata, brachicefalia, fronte prominente, sinofria, fessure palpebrali rivolte verso l’alto, enoftalmo, radice del naso ampia, ipoplasia del terzo mediale della faccia, micrognatia nell’infanzia che diventa prognatismo in età adulta e bocca con il vermiglio carnoso ed estroflesso del labbro superiore [6] (Fig. 3A-B-C). I dati auxologici sono normali alla nascita. La lunghezza e il peso decelerano gradualmente nella prima infanzia. Nel 20% dei bambini, la circonferenza cranica è inferiore al terzo percentile per l’età. Nell’età adulta è frequente la bassa statura. Le anomalie oculari, tra cui lo strabismo (Fig. 3E), la miopia progressiva, le anomalie dell’iride e/o la microcornea, possono progredire con l’età.
La scoliosi (Fig. 3 D) di grado lieve-moderato è presente in circa il 60% delle persone affette dall’età di 4 anni. La stitichezza è frequentemente riportata [6]. È stata segnalata un’aumentata frequenza di anomalie dentali, in particolare agenesia dei premolari e taurodontismo. Altre anomalie organiche comprendono difetti cardiaci (40%), renali (30%), convulsioni, ridotti livelli di immunoglobuline e ipotiroidismo. I problemi otorinolaringoiatrici sono comuni. L’otite media si presenta frequentemente. L’iperacusia è riportata nel 78% dei casi [7]. Sono comuni le anomalie della laringe, tra cui i polipi, edema o paralisi parziale delle corde vocali, insufficienza velo-faringea.
 Sono stati riportati segni clinici di neuropatia periferica in circa il 75% dei pazienti con un aspetto caratteristico delle gambe e dei piedi che è spesso osservato nella malattia di Charcot Marie Tooth. Questo elemento associato all’alterazione del profilo sensoriale e la ridotta sensibilità al dolore giustificherebbe la presenza di anomalie nella marcia [6]. Le difficoltà alimentari sono comuni in epoca infantile. L’ipotonia è riportata in quasi tutti i neonati SMS, accompagnata da iporiflessia (84%) e letargia generalizzata (floppy infant) [6]. La maggioranza dei soggetti mostra una disabilità intellettiva di grado medio-moderato. La valutazione cognitiva non è semplice a causa del disturbo del comportamento e della caduta nelle abilità verbali.
Sono stati riportati segni clinici di neuropatia periferica in circa il 75% dei pazienti con un aspetto caratteristico delle gambe e dei piedi che è spesso osservato nella malattia di Charcot Marie Tooth. Questo elemento associato all’alterazione del profilo sensoriale e la ridotta sensibilità al dolore giustificherebbe la presenza di anomalie nella marcia [6]. Le difficoltà alimentari sono comuni in epoca infantile. L’ipotonia è riportata in quasi tutti i neonati SMS, accompagnata da iporiflessia (84%) e letargia generalizzata (floppy infant) [6]. La maggioranza dei soggetti mostra una disabilità intellettiva di grado medio-moderato. La valutazione cognitiva non è semplice a causa del disturbo del comportamento e della caduta nelle abilità verbali.
È stato descritto un profilo cognitivo con relative debolezze riguardanti la sequenza di elaborazione e la memoria a breve termine [8]. Il fenotipo comportamentale, che comprende stereotipie e comportamenti disadattivi e autolesionisti, è in genere poco riconoscibile prima dei 18 mesi [9]; con l’avanzare dell’età si definisce il deficit di attenzione con o senza iperattività associata. In molti bambini possono essere riconosciuti gli aspetti tipici dell’autismo. Il grado di disturbo del sonno rimane un forte predittore del comportamento disadattivo [6-10] e interessa il 65-100% dei soggetti [10], costituendo verosimilmente la principale maniglia diagnostica della sindrome e rappresentando un problema di grande rilievo per il nucleo familiare in quanto la deprivazione interessa inevitabilmente anche i conviventi.
Il sonno frammentato, con una riduzione del tempo totale di sonno, è stato documentato, grazie alla polisonnografia, nei pazienti con SMS in tutte le fasce di età a partire dall’età di sei mesi [10]. Alla base di tale disturbo sembra esserci l’alterazione del ritmo circadiano della melatonina, che risulta invertito: il picco di rilascio si ha nelle ore diurne e il nadir durante la notte [6-10]. Un miglioramento della qualità e della quantità di sonno ha un effetto diretto positivo sui comportamenti disadattivi in persone con SMS [11]. Poiché la secrezione circadiana della melatonina è controllata dal sistema nervoso simpatico, Leesnyder e collaboratori hanno tentato di ripristinare il corretto ritmo circadiano attraverso il trattamento combinato con β1-bloccante (acebutololo 10 mg/kg in una dose singola) nelle ore diurne e melatonina (6 mg) la sera. L’utilizzo dei due farmaci consentirebbe di bloccare la produzione di melatonina endogena durante il giorno (acebutololo) e di incrementarne i livelli ematici notturni grazie alla somministrazione esogena. Tuttavia, questo approccio non ha ottenuto un successo adeguato in tutti gli individui affetti o spesso non per lunghi periodi [10].
Sono stati tentati altri trattamenti: farmaci neurotropi, antipsicotici, ipnotici, antiepilettici, stimolanti e inibitori del reuptake della serotonina, ecc, con risultati non soddisfacenti [12]. L’alterazione del ritmo circadiano nella SMS potrebbe anche contribuire alla genesi di disturbi metabolici. A tal proposito è stata studiata l’influenza del gene BDNF, fattore di crescita noto per essere coinvolto nel pathway del metabolismo energetico e dei segnali di sazietà, che risulta down-regolato nell'ipotalamo di modelli murini RAI1 +/-, con conseguente iperfagia, alterata risposta alla sazietà ed obesità.
L’obesità troncale è presente fin dall’età scolare nei bambini con SMS [6]. È stato dimostrato che i topi RAI1 +/- alimentati con una dieta ad elevato contenuto di carboidrati o grassi guadagnano peso più velocemente rispetto ai topi wildtipe [13]. L’ipercolesterolemia è presente in oltre il 50% dei pazienti [14]. Sono disponibili insufficienti dati longitudinali per determinare l’aspettativa di vita dei soggetti affetti da SMS; tuttavia, il più anziano individuo con SMS ha vissuto fino all’età di 88 anni [15].
Conclusioni e prospettive
Il disturbo del sonno, del comportamento e la compulsione alimentare rappresentano al tempo stesso "maniglie" diagnostiche e sfide terapeutiche per la SMS.
Al momento non ci sono trattamenti specifici che modifichino il funzionamento di RAI1.
L'impostazione di studi clinici controllati in cieco potrebbe consentire l’apertura di nuove frontiere terapeutiche; nel frattempo, il supporto alle famiglie, la presa in carico multidisciplinare e un trattamento riabilitativo precoce restano le uniche strategie di cura.
Bibliografia
- Smith AC, McGavran L, Robinson J, et al. Interstitial deletion of (17)(p11.2p11.2) in nine patients. Am J Med Genet. 1986;24(3):393-414.
- Elsea SH, Williams SR. Smith-Magenis syndrome: haploinsufficency of RAI1 results in altered gene regulation in neurological and metabolic pathways. Expert Rev Mol Med. 2011 Apr 19;13:e14.
- Girirajan S, Vlangos CN, Szomju BB, et al. Genotype-phenotype correlation in Smith-Magenis syndrome: evidence that multiple genes in 17p11.2 contribute to the clinical spectrum. Genet Med. 2006; 8:417-27.
- Chen L, Mullegama SV, Alaimo JT, et al. Smith-Magenis syndrome and its circadian influence on development, behavior, and obesity - own experience. Dev Period Med. 2015;19(2):149-56.
- Elsea SH, Girirajan S. Smith-Magenis syndrome. Eur J Hum Genet. 2008;16(4):412-21.
- Smith ACM, Boyd KE, Elsea SH, et al. Smith-Magenis Syndrome. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2019. 2001 Oct 22 [updated 2012 Jun 28].
- Hildenbrand HL, Smith AC. Analysis of the sensory profile in children with smith-magenis syndrome. Phys Occup Ther Pediatr. 2012;32:48–65.
- Arron K, Oliver C, Moss J, et al. The prevalence and phenomenology of self-injurious and aggressive behaviour in genetic syndromes. J Intellect Disabil Res. 2011; 55:109–20 10.
- Martin SC, Wolters PL, Smith AC. Adaptive and maladaptive behavior in children with Smith-Magenis Syndrome. J Autism Dev Disord. 2006;36:541–52.
- Gropman AL, Duncan WC, Smith AC. Neurologic and developmental features of the Smith-Magenis syndrome (del 17p11.2). Pediatr Neurol. 2006;34(5):337-50.
- Poisson A, Nicolas A, Cochat P, et al. Behavioral disturbance and treatment strategies in Smith-Magenis syndrome. Orphanet J Rare Dis. 2015;10:111.
- Laje G, Bernert R, Morse R, et al. Pharmacological treatment of disruptive behavior in Smith-Magenis syndrome. Am J Med Genet C Semin Med Genet. 2010; 154C:463–8.
- Alaimo JT, Hahn NC, Mullegama SV, et al. Dietary regimens modify early onset of obesity in mice haploinsu"cient for Rai1. PLoS One. 2014;9(8):e105077.
- Smith AC, Gropman AL, Bailey-Wilson JE, et al. Hypercholesterolemia in children with Smith-Magenis syndrome: del (17) (p11.2p11.2). Genet Med. 2002;4:118–25.
- Arron K, Oliver C, Moss J, et al. The prevalence and phenomenology of self-injurious and aggressive behaviour in genetic syndromes. J Intellect Disabil Res. 2011;55:109–20.




