Le ragioni farmacologiche e farmaco-tecnologiche delle differenze...
Trientina (TETA) prevede la sua somministrazione orale sotto forma...
La malattia di Wilson è una malattia rara ereditaria monogenica recessiva dovuta a mutazione del gene che codifica per la proteina ATP7B responsabile del trasporto e dell’eliminazione del rame e quindi dell’omeostasi di questo elemento nell’organismo (1). Il disturbo provoca accumulo di rame nel fegato e in altri tessuti quali cervello, reni, cornea.
La malattia di Wilson, se non trattata, ha esito fatale, ma per il suo trattamento sono disponibili farmaci efficaci, in grado di arrestare la progressione della malattia in più dell’80% dei pazienti. Il trattamento deve essere proseguito tutta la vita e, pertanto, l’aderenza alla terapia è cruciale nel determinare la prognosi della malattia (2). Trientina (Triethylenetetramine,TETA) è un agente chelante del rame il cui meccanismo d’azione principale è l’eliminazione del rame assorbito dall’organismo attraverso la formazione di un complesso stabile successivamente eliminato mediante escrezione urinaria.
Oggi in Italia sono disponibili due forme saline di trientina indicate per il trattamento della malattia di Wilson in pazienti ≥ 5 anni intolleranti alla D-Penicillammina (DPA):
- N'-[2-(2-amminoetilammino)etil]etan-1,2-diammina (trientina) -sale dicloridrato (TETA2HCl) con due gruppi amminici reattivi
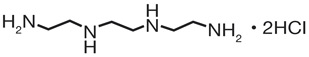
- nuovo sale tetracloridrato (TETA4HCl) senza gruppi amminici reattivi.
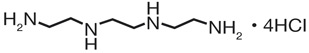
Questa differenza strutturale porta a differenze significative di stabilità e biodisponibilità con un potenziale impatto sulla compliance del paziente.
La diversa salificazione di TETA non comporta una differente efficacia e sicurezza che si basa sull’effetto dello stesso principio attivo, TETA, ma una diversa disponibilità sistemica che conferisce un profilo farmacologico particolarmente vantaggioso, sia in termini posologici sia terapeutici per la formulazione TETA4HCl.
Proprietà farmacocinetiche
Nei pazienti con malattia di Wilson il farmaco è caratterizzato da un assorbimento lento e variabile dopo somministrazione orale. Pochi sono i dati sulla distribuzione che risulta di circa 600 litri e sul modesto legame alle proteine plasmatiche. TETA viene metabolizzata attraverso acetilazione in due metaboliti principali, N(1)-acetil trietilenetetramina (MAT) ed N(1), N(10)-diacetil trietilenetetramina (DAT). Il MAT può anche partecipare all’attività clinica. TETA e i suoi metaboliti vengono rapidamente escreti nelle urine. La farmacocinetica risulta simile tra i volontari sani e i pazienti affetti da malattia di Wilson sia adulti sia in età pediatrica (3).
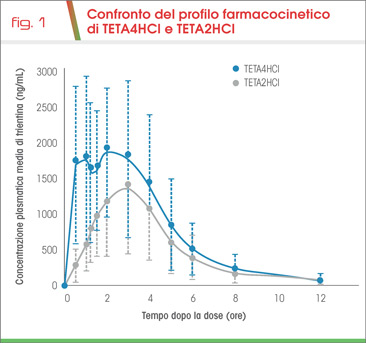 Lo studio Triumph (4) ha confrontato i profili farmacocinetici di TETA 4HCl compresse vs TETA2HCl capsule in 23 volontari di entrambi i sessi che hanno ricevuto la stessa dose equivalente (600 mg) di TETA (Fig. 1). TETA4HCl ha dimostrato una biodisponibilità superiore del 60% con fattore di conversione pari a 0,6. Ne consegue la possibilità di somministrare una quantità di trientina base inferiore per ottenere lo stesso effetto farmacologico che nella pratica consente un dosaggio di TETA4HCl compresse inferiore rispetto a TETA2HCl capsule.
Lo studio Triumph (4) ha confrontato i profili farmacocinetici di TETA 4HCl compresse vs TETA2HCl capsule in 23 volontari di entrambi i sessi che hanno ricevuto la stessa dose equivalente (600 mg) di TETA (Fig. 1). TETA4HCl ha dimostrato una biodisponibilità superiore del 60% con fattore di conversione pari a 0,6. Ne consegue la possibilità di somministrare una quantità di trientina base inferiore per ottenere lo stesso effetto farmacologico che nella pratica consente un dosaggio di TETA4HCl compresse inferiore rispetto a TETA2HCl capsule.
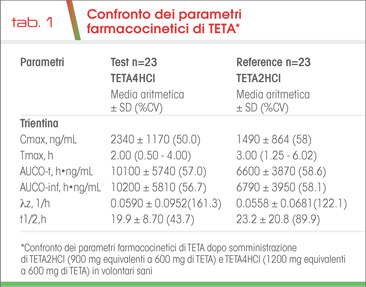
È importante sottolineare che tutti i parametri farmacocinetici (Tmax, Cmax, AUC) che si riferiscono all’assorbimento e all’esposizione sistemica del farmaco risultano significativamente diversi per le due forme farmaceutiche di trientina salificata (Tab. 1).
In particolare, si apprezza una esposizione al farmaco che risulta del 73% e del 75% del valore di Cmax per TETA4HCl e del 21% e del 44% per TETA2HCl a 30 e 60 minuti, rispettivamente, dalla somministrazione.
 Questa caratteristica risulta particolarmente vantaggiosa sia per l’eventuale assunzione di cibo sia per la salvaguardia del paziente. Al contrario, la fase di eliminazione che interessa l’iter del principio attivo presente nel torrente circolatorio risulta simile (T1/2 di eliminazione) a conferma che alla base del diverso profilo farmacologico sono la diversa forma farmaceutica e la differente salificazione di trientina. Questo studio permette di giungere alle seguenti conclusioni:
Questa caratteristica risulta particolarmente vantaggiosa sia per l’eventuale assunzione di cibo sia per la salvaguardia del paziente. Al contrario, la fase di eliminazione che interessa l’iter del principio attivo presente nel torrente circolatorio risulta simile (T1/2 di eliminazione) a conferma che alla base del diverso profilo farmacologico sono la diversa forma farmaceutica e la differente salificazione di trientina. Questo studio permette di giungere alle seguenti conclusioni:
- la non bioequivalenza delle due forme farmaceutiche e la non sostituibilità terapeutica (art. 10, comma 5 DLvo n. 219/06);
- la non equivalenza terapeutica (https://www.aifa.gov.it/documents/20142/0/Determina_818-2018_equivalenza-terapeutica.pdf);
- la diversa posologia per ottenere lo stesso beneficio clinico.
Proprietà farmacodinamiche
In letteratura sono riportati i dati di una relazione lineare tra i dosaggi orali di trientina sia con gli effetti farmacocinetici sia con gli effetti farmacodinamici (escrezione urinaria di rame) (5).
La relazione lineare si conferma come atteso anche con la forma TETA4HCl (studio Triumph2) (6) ad evidenziare l’importanza della correlazione tra esposizione sistemica di TETA ed effetto farmacologico.
Proprietà farmaco-tecnologiche
La correlazione tra concentrazioni plasmatiche ed effetto farmacodinamico di TETA sottolinea l’importanza della prestazione della forma farmaceutica nel rilasciare il principio attivo a cui segue un processo di solubilizzazione che ne permette l’assorbimento. Ne consegue che diversi profili di concentrazione plasmatica-tempo possano determinare una diversa risposta farmacologica.
La diversa velocità di solubilizzazione osservata con i test di dissoluzione tra le capsule contenenti TETA2HCl e le compresse contenenti TETA4HCl documenta una velocità di dissoluzione che risulta 8 volte superiore per la formulazione contenente 4HCl. L’aumentata solubilizzazione si traduce in un più rapido assorbimento, un’aumentata esposizione sistemica ed importanti vantaggi posologici per la formulazione contenente TETA4HCl.
Lo studio clinico Lariboisiere (6), studio di coorte retrospettivo su pazienti trattati con TETA4HCl o TETA2HCl documenta che TETA presente nelle due diverse forme salificate (2HCl vs 4HCl) non differisce significativamente in termini di efficacia e sicurezza.
Tuttavia, grazie al favorevole profilo farmaco-tecnologico e farmacologico, la forma 4HCl permette di impiegare dosaggi inferiori per ottenere la stessa efficacia clinica ad evidenziare i vantaggi non solo posologici ma anche la diversa bioequivalenza e la non equivalenza terapeutica. I recenti risultati dello studio CHELATE (7), studio randomizzato, multicentrico di non inferiorità di TETA4HCl vs DPA confermano il profilo di sicurezza, tollerabilità ed efficacia clinica di TETA4HCl.
Conservazione e stabilità
Il sale 4HCl è stabile tra 25°C e 40°C per cui TETA4HCl può essere conservato a temperatura ambiente. Questo è sicuramente un vantaggio pratico con potenziale impatto sull’aderenza alla terapia.
Conclusioni
La diversa formulazione e la diversa salificazione non comportano una differente efficacia e sicurezza che si basano sull’effetto dello stesso principio attivo, la TETA, ma una diversa bioequivalenza e disponibilità sistemica che conferiscono un profilo farmacologico particolarmente vantaggioso, sia in termini posologici sia terapeutici per la formulazione TETA4HCl oltre ad una non equivalenza terapeutica.
Sulla base di queste premesse, si può affermare che la diversa forma farmaceutica e la diversa salificazione conferiscono caratteristiche farmacocinetiche e proprietà chimico-fisiche differenti che non consentono sic et simpliciter la sostituzione delle formulazioni di TETA4HCl con TETA2HCl e la stessa equivalenza terapeutica.
Bibliografia
- Tanzi RE, Petrukhin K, Chernov I, et al. The Wilson disease gene is a copper transporting ATPase with homology to the Menkes disease gene. Nat Genet. 1993; 5(4):344-50.
- Bruha R, Marecek L, Pospisilova L, et al. Long-term follow-up of Wilson Disease: natural history, treatment, mutation analysis and phenotypic correlation. Liver Int. 2011;31(1):83-91.
- Pfeiffenberger J, Kruse C, Mutch P, et al. The steady state pharmacokinetics of trientine in Wilson disease patients. Eur J Clin Pharmacol. 2018;74(6):731-736.
- Weiss KH, Thompson C, Dogterom P, et al. Comparison of the Pharmacokinetic Profiles of Trientine Tetrahydrochloride and Trientine Dihydrochloride in Healthy Subjects. Eur J Drug Metab Pharmacokinet. 2021;46(5):665-675.
- Cho H-Y, Blum RA, Sunderland T, et al. Pharmacokinetic and pharmacodynamic modeling of a copper-selective chelator (TETA) in healthy adults. J Clin Pharmacol. 2009;49(8):916-28.
- European Medicines Agency. CHMP assessment report. Cuprior. https://www.ema.europa.eu/en/documents/assessment-report/cuprior-epar-public-assessment-report_en.pdf (last accessed: May 2021).
- Morley T. et al. EASL 2021, Poster 2628.





