Malattie rare: modalità di accesso ai farmaci orfani, innovativi...
Per molte malattie rare manca un’efficace terapia, perciò è...
Per molte malattie rare (MR) manca un’efficace terapia, perciò è fondamentale garantire l’accesso ai nuovi farmaci, anche prima che si sia concluso l’iter autorizzativo europeo e che se ne sia deciso il rimborso a livello nazionale.
La necessità di un Early Access alle terapie è presente in tutti quegli ambiti in cui pazienti affetti da una patologia grave non hanno opzioni terapeutiche. Il problema è particolarmente rilevante in Italia, dove, tra la valutazione dell’EMA e l’effettiva disponibilità del farmaco possono trascorrere anche due anni. La conoscenza di questi percorsi a tutela dei bisogni terapeutici non soddisfatti è necessaria per operare scelte prescrittive sicure, appropriate ed efficaci, nonché per portare proposte utili per il miglioramento e la semplificazione della normativa, garantendo un maggiore e più rapido accesso alle nuove terapie.
Legge 648/96
Quando un farmaco per il trattamento di una MR non è registrato per quella patologia o non è in commercio, è opportuno verificare che sia inserito negli elenchi della L.648/96, verificandone i criteri di inclusione ed esclusione per cui ne è stato approvato l’uso.
La richiesta di inserimento richiede una valutazione da parte della Commissione Tecnica Scientifica di AIFA che provvede a stilare un elenco, periodicamente rivalutato, di farmaci forniti a carico del SSN. Sarebbe molto utile l’emissione di una lista specifica per l’off-label consolidato nell’ambito delle MR di facile consultazione per tutti i centri di riferimento.
Off-label: Legge 94/98 (cd. “Di Bella”) e Leggi Finanziarie 2007 e 2008
La normativa attuale, disciplinando un ambito estremamente complesso, pone a tutela del paziente alcuni vincoli sulla disponibilità di evidenze scientifiche e studi di fase II, dal momento che le terapie off-label presentano un profilo rischio-beneficio atteso “incerto” non adeguatamente approfondito in ambito sperimentale.
D’altronde, soprattutto per le MR ed i tumori rari, è frequente che non siano stati condotti studi di fase II; da ciò nasce l’esigenza di rivedere la normativa per quest’ambito e per tutte le aree terapeutiche particolarmente critiche, come quello delle cure palliative e la pediatria, dove spesso, non essendo disponibili farmaci autorizzati, è necessario ricorrere a formulazioni galeniche magistrali.
Sarebbe necessario condurre sperimentazioni cliniche mirate per arrivare a conclusioni definitive su usi off-label, specie se consolidati, ma ancora privi di valutazioni adeguate di rischio/beneficio.
Non da ultimi vengono l’aspetto economico, difficile da sostenere per il paziente trattandosi spesso di terapie onerose e l’accesso a queste quando si tratta di medicinali H non acquistabili dal cittadino né vendibili dall’ospedale. Quest’ultima criticità si può risolvere con una prestazione, inclusiva della terapia, in solvenza, ma andrebbe opportunamente normata. Sarebbe utile tracciare gli usi off-label con un database nazionale per disporre di real world data di efficacia, sicurezza e spesa, in modo da valutarli per l’aggiornamento della L. 648/96 e delle liste per uso consolidato.
Fondo nazionale AIFA (Fondo 5%)
È un fondo istituito con la Legge n. 326 del 2003 per l’impiego, a carico del SSN, di farmaci orfani per il trattamento di MR e di farmaci che rappresentano una speranza di cura, in attesa della commercializzazione, per particolari e gravi patologie.
L’accesso al fondo, effettuato per singolo paziente, consente il rimborso di farmaci anche ad alto costo che, essendo off-label e non potendo rientrare nell’uso compassionevole o essere ricondotti nell’ambito delle MR riconosciute esenti, resterebbero a carico della struttura ospedaliera o del paziente, quando non ricoverato.
Si tratta di una importante opzione che va valutata e, se possibile, percorsa, in quanto il fondo istituito ad hoc ne garantisce la fornitura a carico del SSN.
Importazione dei farmaci dall’estero
L’impiego del farmaco deve avvenire nel rispetto della normativa italiana e delle condizioni d’uso autorizzate nel paese di provenienza, cioè il medicinale deve essere utilizzato solo per le indicazioni terapeutiche per cui è registrato all’estero.
Questa limitazione può essere una criticità per indicazioni particolari, come le MR per cui possono non esserci farmaci registrati nemmeno all’estero, la normativa è chiara: non può essere fatto l’off-label di un farmaco non autorizzato in Italia.
Decreto Ministeriale 7/9/17 (expanded-access o uso terapeutico)
L’accesso alle cure attraverso tale DM può avvenire in due modalità: inserimento di un paziente non trattato nell’ambito di studi clinici, in un programma di uso terapeutico o per uso nominale, quando non ci sono programmi aperti (art. 3, comma 1).
Limitatamente alle MR ed ai tumori rari è introdotta la possibilità di utilizzare farmaci per cui sono disponibili soltanto dati di studi conclusi di fase I (art. 2), e che abbiano documentato l'attività e la sicurezza ad una determinata dose e schedula di trattamento, per indicazioni anche diverse da quella per la quale si richiede l'uso compassionevole. Lo stesso DM evidenzia, infatti, che in questi ambiti “è opportuno tenere in debita considerazione la difficoltà di condurre studi adeguatamente potenziati secondo le metodologie convenzionali”.
Fascia Cnn (non negoziata)
 La legge Balduzzi consente la disponibilità in tempi brevi di nuovi medicinali, subito dopo l’autorizzazione regolatoria. Sono tuttora presenti criticità irrisolte, la mancanza di rimborsabilità blocca l’impiego di molti farmaci in fascia Cnn, poiché le ditte farmaceutiche non li commercializzano prima della rimborsabilità o perché i costi, in genere rilevanti, sono a carico della struttura ospedaliera.
La legge Balduzzi consente la disponibilità in tempi brevi di nuovi medicinali, subito dopo l’autorizzazione regolatoria. Sono tuttora presenti criticità irrisolte, la mancanza di rimborsabilità blocca l’impiego di molti farmaci in fascia Cnn, poiché le ditte farmaceutiche non li commercializzano prima della rimborsabilità o perché i costi, in genere rilevanti, sono a carico della struttura ospedaliera.
Talvolta, per il periodo di permanenza del medicinale in Cnn, la ditta farmaceutica è disponibile alla vendita a prezzo simbolico, ma anche in questi casi l’opzione si presta a valutazioni differenti e non sempre positive: non tutte le aziende sanitarie sono disponibili all’acquisto prima della valutazione di inserimento nel prontuario e prima che AIFA e le singole Regioni pongano eventuali restrizioni sulla rimborsabilità o modalità di prescrizione. Per quanto riguarda le MR, solo in alcune Regioni è garantito l’accesso gratuito ai farmaci in fascia C e Cnn, se indicati nel piano terapeutico: a tale proposito sarebbe necessario porre una deroga, rendendo sempre possibile l’accesso almeno per gli ambiti in cui non sono disponibili terapie alternative.
I percorsi regionali
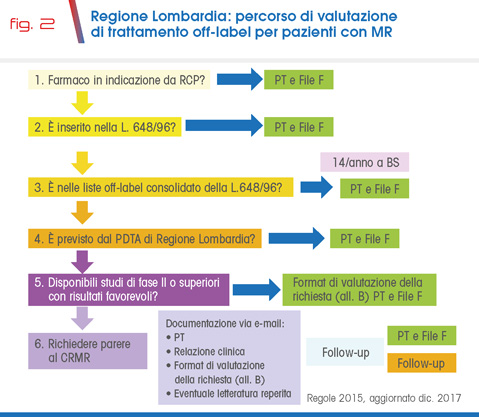 Diverse regioni hanno istituito dei percorsi ad hoc per semplificare l’accesso alle terapie innovative, consentendo, per le MR riconosciute, anche farmaci che non rientrano, ad esempio per le limitate evidenze scientifiche, nella normativa nazionale.
Diverse regioni hanno istituito dei percorsi ad hoc per semplificare l’accesso alle terapie innovative, consentendo, per le MR riconosciute, anche farmaci che non rientrano, ad esempio per le limitate evidenze scientifiche, nella normativa nazionale.
Purtroppo questa possibilità risulta preclusa alle regioni in piano di rientro, si tratta di un vincolo che dovrebbe essere superato, tenendo conto che è un ambito in cui spesso mancano alternative terapeutiche. Le figure 1 e 2 mostrano a titolo esemplificativo i percorsi della Regione Piemonte e della Regione Lombardia.





