Novità nella terapia dell’amiloidosi AL | Negli ultimi anni, i...
Negli ultimi anni, i risultati di studi clinici di fase III e...
Principi di terapia
L’amiloidosi da catene leggere (AL) è una malattia causata dall’alterato ripiegamento proteico di catene leggere libere (CLL) prodotte da un clone plasmacellulare midollare di piccole dimensioni. Il danno d’organo causato dalle CLL è dovuto in parte alla deposizione di queste come fibrille di amiloide e in parte a meccanismi di proteotossicità diretta. Al momento, la terapia per l’amiloidosi AL si basa esclusivamente sulla chemioterapia contro il clone plasmacellulare e ha come scopo la rapida e profonda riduzione della concentrazione delle CLL, che può tradursi in un miglioramento del danno d’organo e della sopravvivenza (1).
Negli ultimi anni, i risultati di studi clinici di fase III e l’introduzione di nuovi farmaci hanno modificato profondamente il trattamento di questa malattia rara. La Società Internazionale per l’Amiloidosi (ISA), in collaborazione con la Società Europea di Ematologia (EHA), ha recentemente pubblicato le linee guida per la terapia dell’amiloidosi AL, comprendenti le linee guida per la terapia comprendente il trapianto autologo di cellule staminali emopoietiche (ASCT) e le linee guida per la chemioterapia non-ASCT (2,3).
Terapia di prima linea
 Le raccomandazioni per la terapia di prima linea delle linee guida ISA/EHA per la chemioterapia non-ASCT sono riassunte nella Figura 1 (3).
Le raccomandazioni per la terapia di prima linea delle linee guida ISA/EHA per la chemioterapia non-ASCT sono riassunte nella Figura 1 (3).
La prima scelta nei pazienti in stadio cardiaco I-IIIa, in assenza di neuropatia, è una terapia con daratumumab – un anticorpo anti-CD38 –, bortezomib, ciclofosfamide e desametasone (Dara-CyBorD). Questa raccomandazione è basata sui risultati dello studio ANDROMEDA, che ha mostrato un tasso di risposta ematologica (92% vs. 77%) e di remissione ematologica completa (CR) (53% vs. 27%) più elevato per Dara-CyBorD, rispetto al solo ciclofosfamide, bortezomib e desametasone (CyBorD) (4).
In alternativa a Dara-CyBorD si può ricorrere ad un trattamento con CyBorD o bortezomib, melphalan e desametasone (BMDex). L’efficacia di quest’ultimo schema terapeutico è stata dimostrata dallo studio AC-004-EU/EMN-03 che confrontava BMDex con il precedente standard terapeutico caratterizzato da melphalan e desametasone (MDex). BMDex ha mostrato un tasso di risposta ematologica dell’81%, con ottenimento di almeno una risposta ematologica parziale molto buona (VGPR) nel 64% dei casi (CR nel 23%) (5).
La scelta tra l’impiego di CyBorD e BMDex dipende dalle caratteristiche cliniche del paziente. CyBorD è preferibile nei pazienti eleggibili o con controindicazioni reversibili all'ASCT e nei pazienti con insufficienza renale.
I pazienti con amiloidosi cardiaca avanzata (stadio cardiaco IIIb) sono soggetti fragili, a rischio elevato di tossicità correlata alla terapia e di mortalità precoce, che richiedono l’impiego di schemi terapeutici a base di daratumumab o bortezomib, preferibilmente a dose attenuata. Daratumumab in monoterapia è una valida opzione terapeutica in questi casi, dati la rapidità e profondità della risposta ematologica e l’ottimo profilo di tollerabilità. Questa strategia terapeutica è attualmente in corso di valutazione all’interno di uno studio clinico di fase II (NCT04131309).
La presenza di neuropatia rappresenta una controindicazione al trattamento con bortezomib. In questi casi, in accordo alle linee guida, la prima scelta è una terapia con daratumumab in monoterapia. In alternativa, è possibile ricorrere ad una terapia con lenalidomide e desametasone, MDex, carfilzomib (solo in pazienti che non presentano interessamento cardiaco) e desametasone o venetoclax.
 La Figura 2 riassume le raccomandazioni contenute nelle linee guida ISA/EHA per la terapia comprendente ASCT (2).
La Figura 2 riassume le raccomandazioni contenute nelle linee guida ISA/EHA per la terapia comprendente ASCT (2).
I pazienti candidabili ad ASCT rappresentano una minoranza dei casi di nuova diagnosi di amiloidosi AL. Tuttavia, questo trattamento si conferma molto efficace, con un tasso di risposta ematologica che supera l’80% (CR nel 39% dei casi). Inoltre, nei pazienti che ottengono una CR, la risposta ematologica può essere mantenuta per molto tempo (mediana di 4.7 anni). In assenza di controindicazioni, l’ASCT può essere preceduto da una terapia di induzione con bortezomib, specialmente in presenza di un infiltrato plasmacellulare midollare >10%. Nel caso in cui la CR è ottenuta già con la sola terapia di induzione, l’ASCT può essere posticipato ai primi segni di progressione ematologica. In accordo con le linee guida, le terapie di consolidamento e di mantenimento sono considerate solo in casi selezionati e non devono essere ritenute uno standard nell’amiloidosi AL.
Terapia dell’amiloidosi AL ricaduta/refrattaria
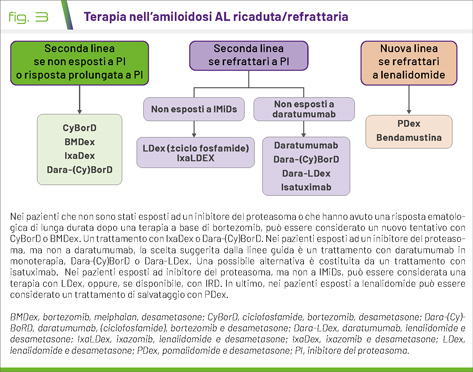 Le raccomandazioni delle linee guida ISA/EHA in merito alla terapia successiva alla prima linea sono schematizzate nella Figura 3.
Le raccomandazioni delle linee guida ISA/EHA in merito alla terapia successiva alla prima linea sono schematizzate nella Figura 3.
Per molti anni, i farmaci immunomodulatori (IMiDs) – in particolare lenalidomide e pomalidomide – hanno rappresentato il cardine della terapia di salvataggio nell’amiloidosi AL. L’utilizzo di schemi a base di bortezomib, invece, è riservato ai pochi casi non esposti ad inibitori del proteasoma o con risposta duratura a bortezomib. Bendamustina, invece, è impiegata nei pazienti trattati con più linee di terapia. Tuttavia, studi clinici recenti hanno fornito delle nuove alternative. La combinazione di ixazomib e desametasone (IxaDex) ha mostrato tassi di risposta ematologica del 63% nei pazienti non esposti a bortezomib nello studio di fase III TOURMALINE-AL1 (6). Inoltre, l’aggiunta di lenalidomide ad IxaDex ha mostrato buoni risultati in uno studio retrospettivo e rappresenta una potente tripletta orale nei pazienti non esposti a IMiDs. Daratumumab è un’opzione efficace come terapia di salvataggio nei pazienti non esposti a questo farmaco, come dimostrato da due studi clinici di fase II, (7,8) dove è stato somministrato in monoterapia. Inoltre, diversi studi retrospettivi hanno riportato l’efficacia di daratumumab in associazione a bortezomib o a lenalidomide. È al momento in corso uno studio clinico di fase II (NCT04895917) che valuta l’efficacia di daratumumab in associazione a pomalidomide e a desametasone. Anche isatuximab – un altro anticorpo anti-CD38 – può rappresentare una valida alternativa nei pazienti non esposti a daratumumab.
Nuove terapie contro il clone B-cellulare
Le nuove terapie in corso di valutazione contro il clone plasmacellulare comprendono farmaci che hanno come bersaglio la proteina anti-apoptotica linfoma a cellule-B 2 (BCL-2) e l’antigene di maturazione delle cellule-B (BCMA). Venetoclax è un inibitore di BCL-2, efficace sia in monoterapia, che in associazione a bortezomib e a daratumumab nel mieloma multiplo. Questo farmaco rappresenta una possibilità interessante nell’amiloidosi AL, data la frequenza elevata della traslocazione t(11;14) nel clone plasmacellulare e la sua dipendenza dall’attività della Ciclina D1. Tuttavia, i dati di efficacia di venetoclax nell’amiloidosi AL si limitano a piccoli studi retrospettivi. Belantamab mafodotin è un anticorpo anti-BCMA coniugato con un agente antitumorale (mafodotin).
L’efficacia di questo farmaco nell’amiloidosi AL è al momento in corso di valutazione in uno studio clinico di fase II (NCT04617925). In ultimo, BCMA può essere anche un bersaglio di una terapia con cellule T con recettore chimerico dell'antigene (CAR-T). I primi dati ottenuti da 4 pazienti con amiloidosi AL recidivata/refrattaria trattati con CAR-T all’interno di uno studio clinico di fase I hanno posto le basi per ulteriori studi sull’utilizzo della terapia con CAR-T nell’amiloidosi AL (9).
Terapie dirette contro le fibrille di amiloide
I tentativi fino ad ora eseguiti per la ricerca di una terapia diretta contro i depositi di amiloide non hanno dato i risultati sperati. Tuttavia, sono al momento in corso di valutazione due anticorpi monoclonali anti-fibrille di amiloide CAEL-101 e birtamimab.
Conclusioni
Nel corso degli ultimi anni, l’introduzione di nuovi farmaci e i risultati dei primi studi di fase III, hanno portato numerose novità nel trattamento dell’amiloidosi AL.
Grazie al crescente numero di studi clinici in corso, sono attesi ulteriori passi avanti in questo campo. In particolar modo, lo sviluppo di terapie efficaci contro i depositi di amiloide potrebbe portare ad un nuovo paradigma della strategia terapeutica dell’amiloidosi AL, andando a colpire contemporaneamente due bersagli: il clone plasmacellulare con la chemioterapia e i depositi di amiloide con la terapia anti-fibrille.
Bibliografia
- Merlini G, Dispenzieri A, Sanchorawala V, et al. Systemic immunoglobulin light chain amyloidosis. Nat Rev Dis Primers. 2018;4(1):38.
- Sanchorawala V, Boccadoro M, Gertz M, et al. Guidelines for high dose chemotherapy and stem cell transplantation for systemic AL amyloidosis: EHA-ISA working group guidelines. Amyloid. 2022;29(1):1-7.
- Wechalekar AD, Cibeira MT, Gibbs SD, et al. Guidelines for non-transplant chemotherapy for treatment of systemic AL amyloidosis: EHA-ISA working group. Amyloid. 2022:1-15.
- Kastritis E, Palladini G, Minnema MC, et al. Daratumumab-Based Treatment for Immunoglobulin Light-Chain Amyloidosis. N Engl J Med. 2021;385(1):46-58.
- Kastritis E, Leleu X, Arnulf B, et al. Bortezomib, Melphalan, and Dexamethasone for Light-Chain Amyloidosis. J Clin Oncol. 2020;38(28):3252-3260.
- Dispenzieri A, Kastritis E, Wechalekar AD, et al. A randomized phase 3 study of ixazomib-dexamethasone versus physician's choice in relapsed or refractory AL amyloidosis. Leukemia. 2022; 36(1):225-235.
- Roussel M, Merlini G, Chevret S, et al. A prospective phase II of daratumumab in previously treated systemic light chain amyloidosis (AL) patients. Blood. 2020;135(18):1531-1540.
- Sanchorawala V, Sarosiek S, Schulman A, et al. Safety, Tolerability, and Response Rates of Daratumumab in Relapsed AL Amyloidosis: Results of a Phase II Study. Blood. 2020;135(18):1541-1547.
- Kfir-Erenfeld S, Asherie N, Grisariu S, et al. Feasibility of a Novel Academic BCMA-CART (HBI0101) for the Treatment of Relapsed and Refractory AL Amyloidosis. Clin Cancer Res. 2022;28(23):5156-5166.





