Nuovo scenario terapeutico per il trattamento dell’emofilia A:...
Emicizumab è un anticorpo monoclonale umanizzato bispecifico...
L'emofilia A è una malattia genetica rara che colpisce prevalentemente i maschi in virtù della trasmissione legata al cromosoma X. È dovuta alle mutazioni del gene F8 (Xp28) che codifica per il fattore (F) VIII della coagulazione ed è caratterizzata da emorragie spontanee causate dal deficit del FVIII della coagulazione. La gravità dei segni clinici dipende dall'entità del deficit del FVIII: severa <1%, moderata 1-5%, lieve 5-40%. Le emorragie si localizzano, spesso, a livello periarticolare e muscolare, ma può essere coinvolta ogni sede anatomica a seguito di traumi o di lesioni. Storicamente, il trattamento si basa sulla terapia sostitutiva con derivati plasmatici o la proteina ricombinante. Questo tipo di terapia può essere effettuato in seguito a emorragie (trattamento a richiesta) o per prevenire il sanguinamento (profilassi).
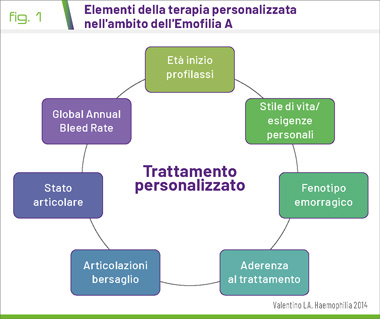 Il razionale alla base di tali trattamenti consente di prevenire le complicazioni rendendo la prognosi favorevole: prima si somministra la terapia sostitutiva personalizzata (1), adatta al quadro clinico del paziente (Fig. 1) e migliore sarà la prognosi.
Il razionale alla base di tali trattamenti consente di prevenire le complicazioni rendendo la prognosi favorevole: prima si somministra la terapia sostitutiva personalizzata (1), adatta al quadro clinico del paziente (Fig. 1) e migliore sarà la prognosi.
La complicazione più frequente è la produzione di anticorpi inibitori rivolti contro il fattore della coagulazione somministrato. La presenza di inibitori ad alto titolo rende inefficace il trattamento con la terapia sostitutiva convenzionale e necessita di un diverso approccio terapeutico. Lo scenario terapeutico è quindi in continua evoluzione.
Registrazione e meccanismo d’azione
Emicizumab (EMCZ) entra a far parte del panorama terapeutico disponibile nel 2018 (2) per il trattamento profilattico di pazienti affetti da emofilia A in tutte le fasce d’età:
- indicazione 1: deficit congenito di FVIII e inibitori del FVIII (3)
- indicazione 2: deficit congenito di FVIII severo in assenza di inibitori diretti verso FVIII.
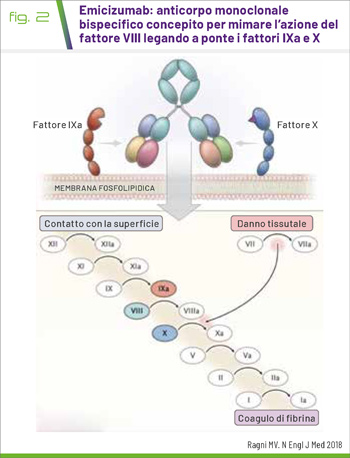 EMCZ è un anticorpo monoclonale umanizzato bispecifico, che lega a ponte il FIX attivato e il FX allo scopo di ripristinare la funzione del FVIII attivato mancante, necessaria per un’efficace emostasi (3) (Fig. 2). EMCZ non presenta correlazione strutturale né sequenziale con il FVIII e pertanto non induce/potenzia lo sviluppo di inibitori diretti del FVIII (4,5).
EMCZ è un anticorpo monoclonale umanizzato bispecifico, che lega a ponte il FIX attivato e il FX allo scopo di ripristinare la funzione del FVIII attivato mancante, necessaria per un’efficace emostasi (3) (Fig. 2). EMCZ non presenta correlazione strutturale né sequenziale con il FVIII e pertanto non induce/potenzia lo sviluppo di inibitori diretti del FVIII (4,5).
Posologia e somministrazione
Il trattamento (inclusa la profilassi di routine) con agenti bypassanti (FVII, complesso protrombinico attivato) deve essere interrotto il giorno prima di iniziare la terapia con EMCZ.
Questa misura precauzionale deriva dall’osservazione di complicanze trombotiche venose e di episodi di microangiopatia trombotica se cosomministrati con EMCZ. La dose raccomandata è di 3 mg/kg una volta a settimana per le prime 4 settimane (dose di carico), seguita da 1,5 mg/kg una volta a settimana (dose di mantenimento), da somministrare mediante iniezione sottocutanea, in sedi specifiche: addome, braccia e cosce (5). Il farmaco viene somministrato tramite l’uso di specifici dispositivi medici (aghi, deflussori). Il farmacista risulta essere l’operatore sanitario di riferimento per informare, educare e formare il paziente/caregiver per la corretta gestione della terapia.
Erogazione, prescrizione ed aspetti economici
Il farmaco è di fascia A (mutuabile) ed è stato inserito nel prontuario ospedale-territorio (PHT) per la continuità terapeutica territoriale e viene erogato in regime di distribuzione diretta presso le farmacie ospedaliere delle ASL (legge 405/2001). Ai fini dell’erogazione a carico del Servizio sanitario nazionale, il farmaco deve essere prescritto da medici specialisti (ematologi, internisti) afferenti a Centri individuati dalle Regioni con prescrizione informatizzata. Il farmacista ne ha accesso sul portale AIFA in tempo reale e nel rispetto della privacy del paziente.
L’istituzione del registro di monitoraggio AIFA web-based permette di vigilare su appropriatezza prescrittiva, aderenza e spesa farmaceutica, nel rispetto degli accordi negoziali.
Il farmaco ha beneficiato dell’innovatività AIFA piena (6) (ciò comporta accesso ai fondi per i farmaci innovativi per il triennio 2018-2021 (7) senza intaccare il budget delle aziende sanitarie pubbliche per l’indicazione 1) e dell’innovatività AIFA condizionata (6) (ovvero disponibilità del farmaco indipendente da inserimento in prontuario aziendale e acquisto tramite fondi aziendali da 03/2019 a 09/2021 (7) per l’indicazione 2).
Oggi EMCZ è acquistato a carico delle aziende ospedaliere per entrambe le indicazioni; nella nostra realtà abbiamo riscontrato che gli shift terapeutici da molecole di vecchia generazione, come octocog alfa, simoctocog alfa (entrambi FVIII rDNA), a EMCZ risultano essere vantaggiosi in termini di qualità della vita (soprattutto dei giovani pazienti) ed economici, migliorando la gestione delle risorse pubbliche con un risparmio del 41,23%.
Conclusioni
La corretta presa in carico del paziente dovrebbe essere l’obiettivo principale di ogni operatore sanitario. Il paziente emofilico fin da bambino ha infatti contatti con l’ambiente ospedaliero; è necessario che impari a convivere con la sua malattia e richiede di essere seguito da un team multidisciplinare di ematologi, ortopedici, fisiatri, infermieri e farmacisti ospedalieri. EMCZ risulta essere estremamente innovativo sia da un punto di vista clinico, come valore aggiunto ad una terapia complessa, che da un punto di vista di processo (informatizzazione). L’innovazione di fatto è a disposizione del paziente.
Bibliografia
- Valentino LA. Considerations in individualizing prophylaxis in patients with haemophilia A. Haemophilia. 2014; 20: 607-615.
- Determina AIFA 712 del 4/5/2018 https://www.aifa.gov.it/sites/default/files/DETERMINA_NP_HEMLIBRA_712.pdf
- Shima M, Hanabusa H, Taki M, et al. Factor VIII-mimetic function of humanized bispecific antibody in hemophilia A. New Engl J Med. 2016;374:2044-53.
- Oldenburg J, Mahlangu JN, Kim B, et al. Emicizumab prophylaxis in hemophilia A with inhibitors. N Engl J Med. 2017;377:809-18.
- Riassunto Caratteristiche del Prodotto (RCP) Emicizumab https://ec.europa.eu/health/documents/community-register/2018/20180223140159/anx_140159_it.pdf
- Valutazione innovatività piena e condizionata secondo AIFA https://www.aifa.gov.it/sites/default/files/HEMLIBRA_v1.0.pdf - https://www.aifa.gov.it/documents/20142/1184740/HEMLIBRA_14410_INNOV._v.1.0.pdf
- Elenco farmaci innovativi: https://www.aifa.gov.it/farmaci-innovativi





