Una insufficienza cardiaca ad eziologia sospetta | Il caso che...
Il caso che presentiamo mostra come nell’amiloidosi cardiaca la...
Giovanni è un uomo di 72 anni, in buona forma fisica, "etichettato" da circa 5 anni come affetto da insufficienza cardiaca a frazione di eiezione conservata in un soggetto iperteso. Da qualche tempo riferisce parestesie agli arti inferiori ed è stato operato di tunnel carpale circa 7 anni fa. Nel 2015 è stato operato di neoplasia prostatica localizzata, senza necessità di successivo trattamento chemio- o radioterapico. Da mesi riferisce un modesto peggioramento degli edemi alle caviglie, che peraltro rispondono bene al temporaneo incremento della terapia diuretica. Si è spaventato per un brusco peggioramento, concomitante ad un episodio di cardiopalmo che lo ha portato in Pronto Soccorso.
In seguito al riscontro di fibrillazione atriale è stato sottoposto a cardioversione elettrica. È marcatamente astenico, tanto che il suo Medico Curante ha deciso di sospendere il beta bloccante che assumeva da tempo. Il Collega del Pronto Soccorso ha sottolineato la presenza di marcata ipertrofia del ventricolo sinistro che ha attribuito alla sua ipertensione arteriosa, peraltro ben controllata dal trattamento con ramipril 10 mg al giorno.
Verso la diagnosi
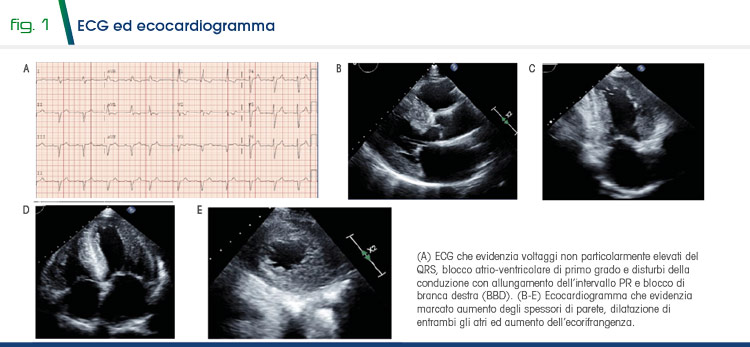
All’ECG sono evidenti voltaggi non particolarmente elevati (a dispetto dell’aumento degli spessori di parete), blocco atrioventricolare di I grado (PR 290 ms) con blocco di branca destra (BBD) (Fig. 1A).
All’ecocardiogramma si evidenziano spessori di parete marcatamente aumentati, una funzione sistolica globale ai limiti inferiori della norma (FE 49%), un riempimento ventricolare di tipo restrittivo, una geometria concentrica ed una lieve insufficienza mitralica. È presente anche una riduzione dello strain longitudinale globale (peraltro conservato a livello apicale) (Fig. 1B-E).
Esami di laboratorio: azotemia 6.2 mmol/L, emoglobina 119 g/L, creatinina 86 µmol/L, Ca 2.2 mmol/L, troponina T 0.217 µg/L, and NT proBNP 24,288 ng/L. L’immunofissazione di siero e urine appare nei limiti (kappa 51.06 mg/dL; lambda 29.89 mg/dL, kappa/lambda ratio 1.71).
Viene a questo punto richiesta una risonanza magnetica nucleare che evidenzia diffuso “delayed enhancement”, aumento degli spessori di parete e riduzione della funzione sistolica globale.
Nel sospetto di amiloidosi è stato sottoposto a biopsia del grasso addominale, risultata negativa per colorazione al Congo rosso. Questo ha indotto il Curante ad escludere inizialmente la presenza di amilodosi.
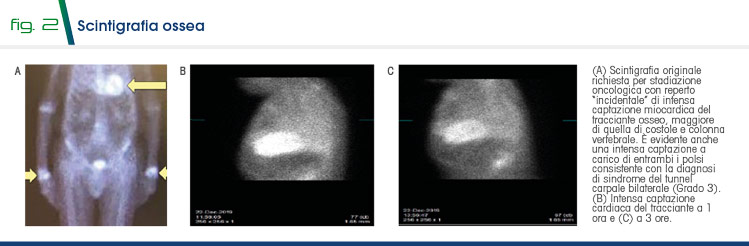
La persistenza della sintomatologia induce a rianalizzare la documentazione del signor Giovanni. Emerge un dato particolare: una pregressa scintigrafia ossea per neoplasia prostatica metastatica ha rilevato come dato incidentale una intensa captazione miocardica del tracciante osseo, maggiore di quella di costole e colonna vertebrale (Grado 3), di difficile interpretazione (Fig. 2A). Una seconda scintigrafia ha evidenziato intensa captazione cardiaca a 1 e 3 ore (Fig. 2B-C).
È stata posta indicazione al test genetico, anche se il paziente era molto scettico. Alla fine il paziente accetta e risulta negativo per mutazioni del gene della transtiretina. La diagnosi è di amiloidosi cardiaca da transtiretina wild-type.
Discussione
Questo caso evidenzia alcuni aspetti diagnostici importanti:
 Il sospetto: “troviamo quello che cerchiamo”. Alcuni elementi ci possono aiutare nell’identificare l’eziologia di una insufficienza cardiaca altrimenti non spiegata. In particolare è utile ricordare come l’acronimo “HIDDEN” possa essere di aiuto (tab.1).
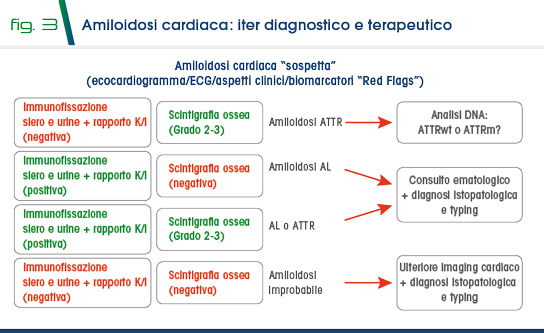
Il sospetto: “troviamo quello che cerchiamo”. Alcuni elementi ci possono aiutare nell’identificare l’eziologia di una insufficienza cardiaca altrimenti non spiegata. In particolare è utile ricordare come l’acronimo “HIDDEN” possa essere di aiuto (tab.1).- L’iter diagnostico (4). Basandosi sull’argoritmo proposto da Gillmore et al (5) è importante che sia posta indicazione a scintigrafia con tracciante osseo (6,7) e a prelievo per immunofissazione di siero e urine.
Questo orienterà la diagnosi e aiuterà nel successivo iter diagnostico e terapeutico come semplificato nello schema rappresentato in figura 3. - La genetica della transtiretina. A volte si è dubbiosi sulla ricerca delle mutazioni note del gene della transitiretina. È importante ricordare che tale valutazione è importante per la famiglia del paziente, in quanto l’assenza di mutazioni ci aiuta a fare diagnosi di amiloidosi cardiaca da transtiretina wild-type mentre il riscontro di una mutazione può essere di grande aiuto per evidenziare eventuali portatori (8-10).
Conclusioni
Come in tutti gli ambiti della medicina, la diagnosi è fondamentale e parte da un sospetto diagnostico. Nel caso dell’amiloidosi cardiaca, la presenza di una insufficienza cardiaca ad eziologia non chiara e di diversi indicatori di sospetto (Red Flags) possono indurre il sospetto diagnostico. La disponibilità di diverse linee di trattamento e la necessità di una diagnosi precoce devono pertanto pungolare il clinico a cercare sempre la causa del quadro di segni e sintomi del nostro paziente.
Bibliografia
- Gonzalez-Lopez E, Gallego-Delgado M, Guzzo-Merello G, et al. Wild-type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J. 2015;36:2585-94.
- Lane T, Fontana M, Martinez-Naharro A, et al. Natural History, Quality of Life, and Outcome in Cardiac Transthyretin Amyloidosis. Circulation. 2019;140:16-26.
- Hahn VS, Yanek LR, Vaishnav J, et al. Endomyocardial Biopsy Characterization of Heart Failure With Preserved Ejection Fraction and Prevalence of Cardiac Amyloidosis. JACC Heart Fail. 2020;8:712-724.
- Maurer MS, Bokhari S, Damy T, et al. Expert Consensus Recommendations for the Suspicion and Diagnosis of Transthyretin Cardiac Amyloidosis. Circ Heart Fail. 2019;12:e006075.
- Gillmore JD, Maurer MS, Falk RH, et al. Non-Biopsy Diagnosis of Cardiac Transthyretin Amyloidosis. Circulation. 2016;133(24):2404-12.
- Hanna M, Ruberg FL, Maurer MS, et al. Cardiac Scintigraphy With Technetium-99m-Labeled Bone-Seeking Tracers for Suspected Amyloidosis: JACC Review Topic of the Week. J Am Coll Cardiol. 2020;75:2851-2862.
- Perugini E, Guidalotti PL, Salvi F, et al. Noninvasive etiologic diagnosis of cardiac amyloidosis using 99mTc-3,3-diphosphono-1,2-propanodicarboxylic acid scintigraphy. J Am Coll Cardiol. 2005;46:1076-84.
- Rapezzi C, Merlini G, Quarta CC, et al. Systemic cardiac amyloidoses: disease profiles and clinical courses of the 3 main types. Circulation. 2009;120:1203-12.
- Grogan M, Scott CG, Kyle RA, et al. Natural History of Wild-Type Transthyretin Cardiac Amyloidosis and Risk Stratification Using a Novel Staging System. J Am Coll Cardiol. 2016;68:1014-20.
- Rapezzi C, Quarta CC, Obici L, et al. Disease profile and differential diagnosis of hereditary transthyretin-related amyloidosis with exclusively cardiac phenotype: an Italian perspective. Eur Heart J. 2013;34:520-8





